题目内容
5.下表是元素周期表的一部分,请参照元素①-⑨在表中的位置,回答下列问题:
(1)①-⑨中金属性最强的元素是Na.最高正价与负价的代数和为6的元素是Cl.(均填元素符号)
(2)写出⑥和⑨形成化合物的电子式
 .
.(3)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是(填化学式)HNO3>H2CO3>H2SiO3.
(4)⑥与沸水反应的化学方程式Mg+2H2O(沸水)=Mg(OH)2+H2↑.
(5)④、⑤、⑦的原子半径由大到小的顺序为(填元素符号)Na>Al>O.
分析 根据元素在周期表中的位置知,①-⑨分别是Li、C、N、O、Na、Mg、Al、Si、Cl元素,
(1)同一周期元素,金属性随着原子序数增大而减弱,同一主族元素,金属性随着原子序数增大而增强;元素最高正化合价与其族序数相等,但O、F元素除外,最低负化合价=族序数-8;
(2)⑥和⑨形成离子化合物氯化镁;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强;
(4)镁和沸水反应生成氢氧化镁和氢气;
(5)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小.
解答 解:根据元素在周期表中的位置知,①-⑨分别是Li、C、N、O、Na、Mg、Al、Si、Cl元素,
(1)同一周期元素,金属性随着原子序数增大而减弱,同一主族元素,金属性随着原子序数增大而增强,所以金属性最强的元素位于周期表左下角,为Na元素;元素最高正化合价与其族序数相等,但O、F元素除外,最低负化合价=族序数-8,最高正价与负价的代数和为6的元素是Cl元素,
故答案为:Na;Cl;
(2)⑥和⑨形成离子化合物氯化镁,电子式为 ,故答案为:
,故答案为: ;
;
(3)元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性N>C>Si,所以最高价氧化物的水化物酸性HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
(4)镁和沸水反应生成氢氧化镁和氢气,方程式为Mg+2H2O (沸水)=Mg(OH)2+H2↑,故答案为:Mg+2H2O (沸水)=Mg(OH)2+H2↑;
(5)原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径大小顺序是Na>Al>O,故答案为:Na>Al>O.
点评 本题考查元素周期表和元素周期律,涉及物质结构、物质性质及元素周期律,明确同一周期、同一主族元素性质递变规律是解本题关键,知道非金属性强弱、金属性强弱判断方法,题目难度不大.

 考前必练系列答案
考前必练系列答案| A. | 加水稀释 | B. | 加少量NaOH溶液 | C. | 降低温度 | D. | 锌片改为锌粉 |
| A. | CO2和SiO2 | B. | AlCl3 和NaOH | C. | 氩和P4 | D. | 金刚石和水晶 |
| A. | 2mol/L | B. | 1.8mol/L | C. | 2.4 mol/L | D. | 3.6 mol/L |
| A. | HCO3-+H2O?CO32-+H3O+ | B. | H2O+H2O?H3O++OH- | ||
| C. | CO2+H2O?H2CO3 | D. | CO32-+H2O?HCO3-+OH- |
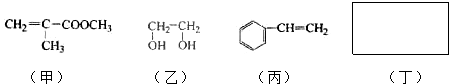
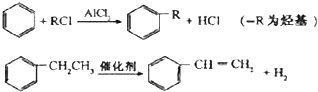
 .
. .
. ③
③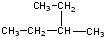 ④
④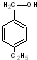 ⑤
⑤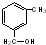 ⑥
⑥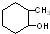
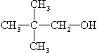 .
.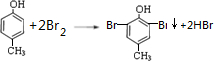 .
.
 .
. 已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题:
已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题: