题目内容
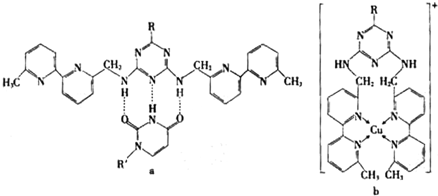
 (2008?广东)已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100mL水中至刚好饱和,该过程中Ag+和S
(2008?广东)已知Ag2SO4的KW 为2.0×10-3,将适量Ag2SO4固体溶于100mL水中至刚好饱和,该过程中Ag+和S| O | 2- 3 |
分析:计算溶液混合后银离子和硫酸根离子的浓度,再 计算浓度幂之积,与平衡常数相比较,判断溶液离子浓度变化.
解答:解:Ag2SO4刚好为100ml的饱和溶液,因为c(Ag+)=0.034mol?L-1,则c(SO42-)=0.017mol?L-1;
当加入100ml 0.020mol?L-1Na2SO4溶液后,c(SO42-)=
=0.0185mol?L-1,c(Ag+)=0.017mol?L-1,
若没有沉淀析出,则混合后银离子浓度为原来的一半,硫酸根离子浓略有增大,由此可以看出应为B图象,
此时Q=c(SO42-)?c2(Ag+)=0.0185×(0.017)2=5.346×10-6<Ksp=2.0×10-3,则该溶液中没有沉淀析出,
故选B.
当加入100ml 0.020mol?L-1Na2SO4溶液后,c(SO42-)=
| 0.017+0.020 |
| 2 |
若没有沉淀析出,则混合后银离子浓度为原来的一半,硫酸根离子浓略有增大,由此可以看出应为B图象,
此时Q=c(SO42-)?c2(Ag+)=0.0185×(0.017)2=5.346×10-6<Ksp=2.0×10-3,则该溶液中没有沉淀析出,
故选B.
点评:本题考查本题考查了沉淀溶解平衡移动,考查了学生对图表、文字信息的获取与分析应用能力,要求学生掌握溶度积常数的基本概念以及简单应用.

练习册系列答案
相关题目


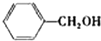
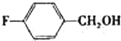
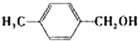
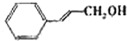
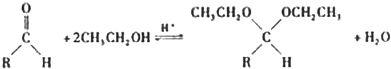
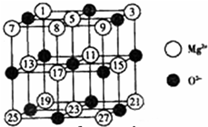 (2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.
(2008?广东)镁、铜等金属离子是人体内多种酶的辅因子.工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁.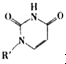 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b: