题目内容
高温超导材料是科学家研究的重点物质之一.
(1)科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图1所示.该富勒烯化合物中的K原子和C60分子的个数比为

(2)某同学画出的C的核外电子排布(轨道表示式)如图2所示,该电子排布图(轨道表示式)违背了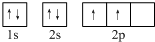
 .
.
(3)金属钾采用的是图3中的
(4)富勒烯(C60)的结构如图4所示.
①1mol C60分子中σ键的数目为
②已知:金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm.有同学据此推断C60的熔点高于金刚石,你认为是否正确并阐述理由:
(1)科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图1所示.该富勒烯化合物中的K原子和C60分子的个数比为
3:1
3:1
.
(2)某同学画出的C的核外电子排布(轨道表示式)如图2所示,该电子排布图(轨道表示式)违背了
洪特规则
洪特规则
,请你画出正确的电子排布图(轨道表示式)

(3)金属钾采用的是图3中的
A
A
(填字母代号)堆积方式.(4)富勒烯(C60)的结构如图4所示.
①1mol C60分子中σ键的数目为
90NA
90NA
.②已知:金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm.有同学据此推断C60的熔点高于金刚石,你认为是否正确并阐述理由:
错误,因为金刚石是原子晶体,而C60是分子晶体
错误,因为金刚石是原子晶体,而C60是分子晶体
.分析:(1)利用均摊法确定K原子和C60分子的个数比;
(2)根据洪特规则可知,电子排布时优先占据1个轨道,且自旋方向相同;
(3)钾是体心立方堆积,其配位数是8;
(4)①利用均摊法计算一个碳原子含有的σ键个数,在计算1mol C60分子中σ键的数目;
②物质的熔点与晶体类型有关,原子晶体的熔点大于分子晶体.
(2)根据洪特规则可知,电子排布时优先占据1个轨道,且自旋方向相同;
(3)钾是体心立方堆积,其配位数是8;
(4)①利用均摊法计算一个碳原子含有的σ键个数,在计算1mol C60分子中σ键的数目;
②物质的熔点与晶体类型有关,原子晶体的熔点大于分子晶体.
解答:解:(1)该晶胞中C60个数=1+8×
=2,6×2×
=6,所以K原子和C60分子的个数比为6:2=3:1,故答案为:3:1;
(2)根据洪特规则可知,电子排布时优先占据1个轨道,且自旋方向相同,所以其轨道排布图违反了洪特规则,其电子排布图为: ,
,
故答案为:洪特规则, ;
;
(3)钾是体心立方堆积,其配位数是8,故选A;
(4)①1个 C60分子中的一个碳原子含有1.5个σ键,所以一个 C60分子中含有90个σ键,则1mol C60分子中σ键的数目为90NA,
故答案为:90NA;
②原子晶体的熔点大于分子晶体,金刚石是原子晶体,C60是分子晶体,物质的熔点与键长无关,所以该说法错误,故答案为:错误,因为金刚石是原子晶体,而C60是分子晶体.
| 1 |
| 8 |
| 1 |
| 2 |
(2)根据洪特规则可知,电子排布时优先占据1个轨道,且自旋方向相同,所以其轨道排布图违反了洪特规则,其电子排布图为:
 ,
,故答案为:洪特规则,
 ;
;(3)钾是体心立方堆积,其配位数是8,故选A;
(4)①1个 C60分子中的一个碳原子含有1.5个σ键,所以一个 C60分子中含有90个σ键,则1mol C60分子中σ键的数目为90NA,
故答案为:90NA;
②原子晶体的熔点大于分子晶体,金刚石是原子晶体,C60是分子晶体,物质的熔点与键长无关,所以该说法错误,故答案为:错误,因为金刚石是原子晶体,而C60是分子晶体.
点评:本题考查了物质结构和性质,涉及晶胞的计算、电子排布图等知识点,难度不大,离子配位数的判断是学习难点,会运用均摊法计算化学键、晶胞的化学式等.

练习册系列答案
相关题目








