题目内容
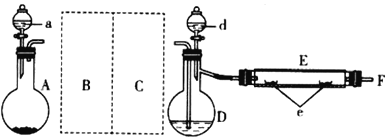
【题目】某研究性学习小组拟探究CuCl2·2H2O的热稳定性,进行如下操作:
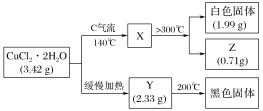
上述所列物质都是纯净物,请回答:
(1)气流C的结构式________,白色固体的化学式________。
(2)已知Y的摩尔质量为233 g·mol-1,完成CuCl2·2H2O缓慢加热分解的化学方程式_______。
(3)最简单制取白色固体的化合反应方程式是_____。
【答案】H—Cl CuCl 2(CuCl2·2H2O)![]() Cu2(OH)2Cl2+2HCl↑+2H2O Cu+CuCl2
Cu2(OH)2Cl2+2HCl↑+2H2O Cu+CuCl2![]() 2CuCl
2CuCl
【解析】
(1)气流C是保护气,用于抑制盐的水解,通常为盐对应的酸;白色固体应为无水盐的分解产物。
(2)在没有保护气的情况下,盐受热水解,要么水解生成碱式盐,要么水解生成碱,可通过验证两种可能水解产物的相对分子质量,确定该物质。
(3)最简单制取白色固体,可采用金属与高价金属氯化物反应。
(1)气流C是HCl,为共价化合物,其结构式为H-Cl,加入HCl的目的是作保护气,抑制加热过程CuCl2可能的水解,X是CuCl2,高于300 ℃加热,再次分解,白色固体只能是CuCl。答案为:H-Cl;CuCl;
(2)在没有HCl的保护下,CuCl2可能发生水解,生成Cu2(OH)2Cl2或Cu(OH)2,用摩尔质量判断,从而确定产物为Cu2(OH)2Cl2。分解反应的方程式为2(CuCl2·2H2O)![]() Cu2(OH)2Cl2+2HCl↑+2H2O。答案为:2(CuCl2·2H2O)
Cu2(OH)2Cl2+2HCl↑+2H2O。答案为:2(CuCl2·2H2O)![]() Cu2(OH)2Cl2+2HCl↑+2H2O;
Cu2(OH)2Cl2+2HCl↑+2H2O;
(3)Cl2和金属反应只能生成高价态CuCl2,最简单的化合反应就是Cu+CuCl2![]() 2CuCl。答案为:Cu+CuCl2
2CuCl。答案为:Cu+CuCl2![]() 2CuCl。
2CuCl。

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目