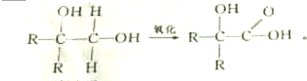题目内容
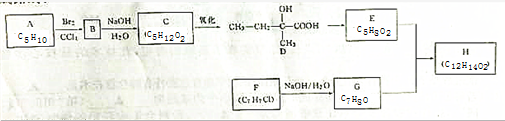
实验室模拟合成 和CH3CH2CH2Br的方法如图1(已知:甲苯和液溴在有水存在时也能反应):
和CH3CH2CH2Br的方法如图1(已知:甲苯和液溴在有水存在时也能反应):

实验室模拟合成对溴甲苯和1.溴丙烷的流程如图2和相关数据如下:
(1)实验室存放液溴的试剂瓶需密闭,同时瓶中要加入 ,以减少溴的挥发.写出甲苯和液溴反应生成对溴甲苯的化学方程式 .
(2)反应装置如图3所示:
①图中玻璃仪器a的名称是 ,方块b中为某玻璃仪器,其名称是 .
②三颈烧瓶中开始加入了甲苯、铁粉和水.加入的适量水的作用是:易于控制温度和 .加热
搅拌操作中加入浓硫酸,完成1.丙醇的取代反应,浓硫酸的作用是 .
(3)操作I的名称是 ,操作Ⅲ的名称是 .
(4)操作1分离出的水溶液中含有H2SO4和Fe3+,某同学为测定HBr的物质的量,设计方案如下:将所得水溶液稀释至l000mL,取出20mL,用0.1mol/L NaOH溶液滴定,以测定HBr的物质的量.该同学认为无需加入指示剂,也能完成滴定.他提出这一观点的理由是: .
 和CH3CH2CH2Br的方法如图1(已知:甲苯和液溴在有水存在时也能反应):
和CH3CH2CH2Br的方法如图1(已知:甲苯和液溴在有水存在时也能反应):
实验室模拟合成对溴甲苯和1.溴丙烷的流程如图2和相关数据如下:
| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 | 对溴甲苯 | 邻溴甲苯 |
| 沸点(℃) | 110.8 | 97.2 | 71 | 184.3 | 181.7 |

(2)反应装置如图3所示:
①图中玻璃仪器a的名称是
②三颈烧瓶中开始加入了甲苯、铁粉和水.加入的适量水的作用是:易于控制温度和
搅拌操作中加入浓硫酸,完成1.丙醇的取代反应,浓硫酸的作用是
(3)操作I的名称是
(4)操作1分离出的水溶液中含有H2SO4和Fe3+,某同学为测定HBr的物质的量,设计方案如下:将所得水溶液稀释至l000mL,取出20mL,用0.1mol/L NaOH溶液滴定,以测定HBr的物质的量.该同学认为无需加入指示剂,也能完成滴定.他提出这一观点的理由是:
考点:制备实验方案的设计
专题:
分析:(1)液溴为深红棕色液体,易挥发,为减少挥发,可用水封的方法保存;甲苯和液溴反应生成对溴甲苯和溴化氢,发生取代反应;
(2)甲苯与1-丙醇共热合成对溴甲苯和1-溴丙烷,加热搅拌操作中加入浓硫酸,搅拌,完成1-丙醇的取代反应,浓硫酸起到催化剂的作用,为提高氢溴酸和1-丙醇的利用(转化)率,加热微沸2小时,使之充分反应,然后用分液漏斗分离,粗对溴甲苯中还含有的最主要杂质为邻溴甲苯,可利用物质的沸点差异,用加热冷凝(蒸馏或分馏)的方法分离,以此解答该题;
①依据装置图分析仪器名称和作用,b处是加入粗产品的仪器用分液漏斗分液加入;
②依据生成的溴化氢极易溶于水分析其作用;
(3)依据上述分析可知操作Ⅰ时分液,操作Ⅲ为蒸馏分离方法;
(4)水溶液中含有H2SO4和Fe3+,为测定HBr的物质的量,滴入氢氧化钠溶液到最后一滴生成红褐色沉淀证明溴化氢完全反应;
(2)甲苯与1-丙醇共热合成对溴甲苯和1-溴丙烷,加热搅拌操作中加入浓硫酸,搅拌,完成1-丙醇的取代反应,浓硫酸起到催化剂的作用,为提高氢溴酸和1-丙醇的利用(转化)率,加热微沸2小时,使之充分反应,然后用分液漏斗分离,粗对溴甲苯中还含有的最主要杂质为邻溴甲苯,可利用物质的沸点差异,用加热冷凝(蒸馏或分馏)的方法分离,以此解答该题;
①依据装置图分析仪器名称和作用,b处是加入粗产品的仪器用分液漏斗分液加入;
②依据生成的溴化氢极易溶于水分析其作用;
(3)依据上述分析可知操作Ⅰ时分液,操作Ⅲ为蒸馏分离方法;
(4)水溶液中含有H2SO4和Fe3+,为测定HBr的物质的量,滴入氢氧化钠溶液到最后一滴生成红褐色沉淀证明溴化氢完全反应;
解答:
解:(1)实验室存放液溴的试剂瓶需密闭,液溴为深红棕色液体,易挥发,为减少挥发,可用水封的方法保存,以减少溴的挥发;甲苯和液溴发生取代反应生成对溴甲苯的化学方程式:
故答案为:水; ;
;
(2)甲苯与1-丙醇共热合成对溴甲苯和1-溴丙烷,加热搅拌操作中加入浓硫酸,搅拌,完成1-丙醇的取代反应,浓硫酸起到催化剂的作用,为提高氢溴酸和1-丙醇的利用(转化)率,加热微沸2小时,使之充分反应,然后用分液漏斗分离,粗对溴甲苯中还含有的最主要杂质为邻溴甲苯,可利用物质的沸点差异,用加热冷凝(蒸馏或分馏)的方法分离,以此解答该题;
①依据装置图分析仪器名称和作用分析仪器a为冷凝管,b处是加入粗产品的仪器用分液漏斗分液加入,方块b中为某玻璃仪器为分液漏斗;
故答案为:冷凝管,分液漏斗;
②依据生成的溴化氢极易溶于水分析,三颈烧瓶中开始加入了甲苯、铁粉和水.加入的适量水的作用是:易于控制温度和吸收溴化氢,加热搅拌操作中加入浓硫酸,完成1.丙醇的取代反应,浓硫酸的作用是催化剂的作用;
故答案为:吸收反应生成的HBr气体;催化剂;
(3)依据上述分析可知操作Ⅰ时分液,操作Ⅲ为蒸馏分离方法;
故答案为:分液,蒸馏;
(4)水溶液中含有H2SO4和Fe3+,为测定HBr的物质的量,滴入氢氧化钠溶液到最后一滴生成红褐色沉淀证明溴化氢完全反应;
故答案为:滴定终点时,有红褐色Fe(OH)3沉淀生成,可以指示滴定终点;

故答案为:水;
 ;
;(2)甲苯与1-丙醇共热合成对溴甲苯和1-溴丙烷,加热搅拌操作中加入浓硫酸,搅拌,完成1-丙醇的取代反应,浓硫酸起到催化剂的作用,为提高氢溴酸和1-丙醇的利用(转化)率,加热微沸2小时,使之充分反应,然后用分液漏斗分离,粗对溴甲苯中还含有的最主要杂质为邻溴甲苯,可利用物质的沸点差异,用加热冷凝(蒸馏或分馏)的方法分离,以此解答该题;
①依据装置图分析仪器名称和作用分析仪器a为冷凝管,b处是加入粗产品的仪器用分液漏斗分液加入,方块b中为某玻璃仪器为分液漏斗;
故答案为:冷凝管,分液漏斗;
②依据生成的溴化氢极易溶于水分析,三颈烧瓶中开始加入了甲苯、铁粉和水.加入的适量水的作用是:易于控制温度和吸收溴化氢,加热搅拌操作中加入浓硫酸,完成1.丙醇的取代反应,浓硫酸的作用是催化剂的作用;
故答案为:吸收反应生成的HBr气体;催化剂;
(3)依据上述分析可知操作Ⅰ时分液,操作Ⅲ为蒸馏分离方法;
故答案为:分液,蒸馏;
(4)水溶液中含有H2SO4和Fe3+,为测定HBr的物质的量,滴入氢氧化钠溶液到最后一滴生成红褐色沉淀证明溴化氢完全反应;
故答案为:滴定终点时,有红褐色Fe(OH)3沉淀生成,可以指示滴定终点;
点评:本题考查了物质制备的方法分析和流程判断,装置仪器的作用理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列说法不正确的是( )
| A、胶体都有丁达尔现象 |
| B、向FeCl3溶液中加入KSCN,最终会看到血红色沉淀 |
| C、氢氧化铁胶体的分散质可以透过滤纸 |
| D、向硫酸铜溶液中加入一小块金属钠,最终会看到蓝色沉淀 |
下列关于纯净物、混合物、强电解质、弱电解质和非电解质的正确组合是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 玻璃 | 硫酸 | 氨水 | 干冰 |
| B | 氢氧化钡 | 植物油 | 硫酸钡 | 醋酸 | 水 |
| C | 胆矾 | 淀粉 | 熟石灰 | 水 | 氨气 |
| D | 硝酸 | 汽油 | 硫酸 | 氢硫酸 | 氢气 |
| A、A | B、B | C、C | D、D |
暴露于空气中不易变质的是( )
| A、水玻璃 |
| B、苏打 |
| C、Na2O2 |
| D、漂白液 |
下列说法正确的是( )
| A、HCO3-在水溶液中只电离,不水解 |
| B、硝酸钠溶液水解之后呈中性 |
| C、可溶性的铝盐都能发生水解反应 |
| D、可溶性的钾盐都不能发生水解反应 |

 I.有机物A为绿色荧光蛋白在一定条件下水解的最终产物之一,结构简式如图.
I.有机物A为绿色荧光蛋白在一定条件下水解的最终产物之一,结构简式如图.