题目内容
【题目】25℃时,0.1mol/L的HA溶液中 ![]() =1010 , 0.01mol/L的BOH溶液pH=12.请回答下列问题:
=1010 , 0.01mol/L的BOH溶液pH=12.请回答下列问题:
(1)HA是(填“强电解质”或“弱电解质”,下同),BOH是 .
(2)HA的电离方程式是 . 其中由水电离出的c(H+)=mol/L
(3)在加水稀释HA的过程中,随着水量的增加而减小的是(填字母).
A.![]()
B.![]()
C.c(H+)与c(OH﹣)的乘积
D.c(OH﹣)
(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合后的溶液呈性,请用离子方程式解释其原因 , 混合溶液中各离子浓度由大到小的顺序是 .
(5)常温下pH=12的BOH溶液100mL,加0.01mol/L NaHSO4使溶液的pH为11.(混合溶液体积变化忽略不计),应加 NaHSO4mL(保留到小数点后一位)
【答案】
(1)弱电解质;强电解质
(2)HA?H++A﹣;10﹣12
(3)B
(4)碱;A﹣+H2O?HA+OH﹣;c(B+)>c(A﹣)>c(OH﹣)>c(H+)
(5)8.18
【解析】解:(1)25℃时,0.1mol/L的HA溶液中 ![]() =1010、c(OH﹣).c(H+)=10﹣14 , 则该溶液中c(H+)=0.01mol/<0.1mol/L,所以HA是弱酸,则HA是弱电解质; 0.01mol/L的BOH溶液pH=12,该溶液中c(OH﹣)=
=1010、c(OH﹣).c(H+)=10﹣14 , 则该溶液中c(H+)=0.01mol/<0.1mol/L,所以HA是弱酸,则HA是弱电解质; 0.01mol/L的BOH溶液pH=12,该溶液中c(OH﹣)= ![]() mol/L=0.01mol/L=c(BOH),所以BOH是强碱,则BH是强电解质;
mol/L=0.01mol/L=c(BOH),所以BOH是强碱,则BH是强电解质;
所以答案是:弱电解质;强电解质; (2)HA是弱酸,在水溶液中存在电离平衡,电离方程式为HAH++A﹣;该溶液中水电离出的c(H+)=c(OH﹣)= ![]() mol/L=10﹣12 mol/L,
mol/L=10﹣12 mol/L,
所以答案是:HAH++A﹣;10﹣12; (3)加水稀释促进HA电离,溶液中HA电离增大程度小于溶液体积增大程度,所以c(H+)减小,溶液中c(HA)、c(A﹣)减小,溶液温度不变,离子积常数不变,则溶液中c(OH﹣)增大;
A.加水稀释促进HA电离,n(H+)增大、n(HA)减小,溶液体积相同,所以 ![]() 增大,故错误;
增大,故错误;
B.加水稀释促进HA电离,n(A﹣)增大、n(HA)减小,溶液体积相同,所以 ![]() 减小,故正确;
减小,故正确;
C.温度不变,水的离子积常数不变,所以c(H+)与c(OH﹣)的乘积不变,故错误;
D.加水稀释促进HA电离,溶液中HA电离增大程度小于溶液体积增大程度,所以c(H+)减小,溶液温度不变,离子积常数不变,则溶液中c(OH﹣)增大,故错误;
故选B;(4)将等体积等物质的量浓度的HA溶液和BOH溶液混合,二者恰好反应生成BA,BA为强碱弱酸盐,酸根离子水解导致溶液呈碱性,则c(OH﹣)>c(H+),但其水解程度较小,结合电荷守恒得c(B+)>c(A﹣),所以离子浓度大小顺序是c(B+)>c(A﹣)>c(OH﹣)>c(H+),其水解方程式为 A﹣+H2OHA+OH﹣ , 所以答案是:碱性; A﹣+H2OHA+OH﹣;c(B+)>c(A﹣)>c(OH﹣)>c(H+);(5)常温下pH=12的BOH溶液中c(OH﹣)= ![]() mol/L=0.01mol/L,硫酸氢钠是强酸酸式盐,其完全电离生成钠离子、氢离子和硫酸根离子,相当于强酸性溶液,硫酸氢钠溶液中c(H+)=0.01mol/L,混合溶液pH=11>7,混合溶液中
mol/L=0.01mol/L,硫酸氢钠是强酸酸式盐,其完全电离生成钠离子、氢离子和硫酸根离子,相当于强酸性溶液,硫酸氢钠溶液中c(H+)=0.01mol/L,混合溶液pH=11>7,混合溶液中 ![]() mol/L=0.001mol/L,则混合溶液呈碱性,混合溶液中c(OH﹣)=
mol/L=0.001mol/L,则混合溶液呈碱性,混合溶液中c(OH﹣)= ![]() =0.001mol/L,x=81.8mL,
=0.001mol/L,x=81.8mL,
所以答案是:81.8.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

【题目】下列实验事实不能用平衡移动原理解释的是( )
A.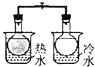 将NO2球浸泡在冷水和热水中
将NO2球浸泡在冷水和热水中
B.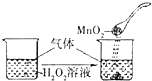 向H2O2溶液中滴加MnO2粉末
向H2O2溶液中滴加MnO2粉末
C.
T(℃) | 25 | 50 | 100 |
水的离子积常数KW(×10﹣14) | 1.01 | 5.47 | 55.0 |
D.
c(氨水)/mol.L﹣1 | 0.1 | 0.01 |
pH | 11.1 | 10.6 |