题目内容
18.将BaCl2•xH2O的晶体2.44g溶于水,配成100mL溶液,取此溶液25mL,与8.5g 10%的AgNO3溶液相作用,刚好把Cl-沉淀完全.求:(1)2.44g BaCl2•xH2O的物质的量;
(2)BaCl2•xH2O的相对分子质量;
(3)BaCl2•xH2O的x值.
分析 根据硝酸银的量可以确定银离子的物质的量,根据银离子和氯离子沉淀的关系,可以确定氯离子的物质的量的多少,进而确定氯化钡的物质的量以及相对分子质量,得出x的值.
解答 解:(1)硝酸银的质量为:8.5g×10%=0.85g,所以物质的量为:$\frac{0.85g}{170g/mol}$=0.005mol,含有银离子的物质的量是0.005mol,所以25mL氯化钡中氯离子的物质的量是0.005mol,100mL氯化钡中氯离子的物质的量是0.02mol,BaCl2•xH2O的物质的量是0.01mol,
答:2.44g BaCl2•xH2O的物质的量是0.01mol;
(2)2.44g BaCl2•xH2O的物质的量是0.01mol,M=$\frac{2.44g}{0.01mol}$=244g/mol,相对分子质量在数值上和摩尔质量是相等的,相对分子质量为244,
答:BaCl2•xH2O的相对分子质量是244;
(3)BaCl2•xH2O的相对分子质量244=18x+208,所以x=2,答:x的值为2.
点评 本题是一道关于物质的量浓度的计算题,可以根据氯化钡和硝酸银反应生成氯化银的反应得出解题的突破点,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.下列叙述正确的是( )
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子 | |
| B. | 溶于水后能电离出氢离子的化合物一定是酸 | |
| C. | 硫酸钡难溶于水,但硫酸钡属于电解质 | |
| D. | 氯气溶于水后的溶液能导电,故氯气属于电解质 |
6.下列反应中,属于加成反应的是( )
| A. | CH3Cl+Cl2$\stackrel{光照}{→}$CH2Cl2+HCl | |
| B. | CH2=CH2+HOCl$\stackrel{催化剂}{→}$HOCH2-CH2Cl | |
| C. | 2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| D. | 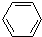 +Br2$\stackrel{催化剂}{→}$ +Br2$\stackrel{催化剂}{→}$ -Br+HBr -Br+HBr |
13.某高聚物的片断结构为 合成该高分子化合物的单体是( )
合成该高分子化合物的单体是( )
 合成该高分子化合物的单体是( )
合成该高分子化合物的单体是( )| A. | CH2=CH2 | B. | CH2=CH-CH3 | C. | CH3CH2CH3 | D. | CH3CH(CH3)CH3 |
3.关于钠与水反应的现象,下列说法错误的是( )
| A. | 钠熔化成银白色小球 | B. | 钠沉在水底 | ||
| C. | 反应剧烈 |
8.关于分液漏斗的使用,下列说法正确的是( )
| A. | 可在分液漏斗内用四氯化碳萃取碘酒中的碘单质 | |
| B. | 分液漏斗在使用前只需检查旋塞芯处是否漏水即可 | |
| C. | 放出下层液体时,应打开上方的玻璃塞,并使下端管口紧贴烧杯内壁 | |
| D. | 放出下层液体后,再从漏斗下端口放出上层液体. |
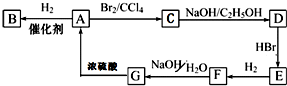 图中A~G均为有机化合物,根据图中的转化关系(反应条件略去),回答下列问题:
图中A~G均为有机化合物,根据图中的转化关系(反应条件略去),回答下列问题:
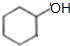 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O反应类型是消去反应.由F生成G的化学方程式
+H2O反应类型是消去反应.由F生成G的化学方程式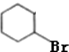 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +2H2O.
+2H2O.