题目内容
14.除去下列物质中含有的少量杂质,请选择合适的所给试剂、操作方法填入下表中(只填序号)试剂:A.溴水 B.NaOH溶液 C.CaO D.酸性KMnO4 溶液 E.饱和Na2CO3溶液
操作方法:a.蒸馏 b.分液 c.洗气 d.过滤 e.干馏 f.分馏 g.裂化
| 组别 | 物质 | 杂质 | 试剂 | 操作方法 |
| 1 | 乙烷 | 乙烯 | ||
| 2 | 溴苯 | 溴 | ||
| 3 | 乙酸乙酯 | 乙酸 | ||
| 4 | 乙醇 | 水 | ||
| 5 | 将重油转化为汽油 | |||
| 6 | 把煤转化为焦炉气、煤焦油和焦炭等 | |||
分析 乙烯与溴水反应,而乙烷不能;
溴与NaOH溶液反应后,与溴苯分层;
乙酸与碳酸钠溶液反应后,与乙酸乙酯分层;
水与CaO反应后,增大与乙醇的沸点差异;
将重油转化为汽油,需要发生裂化反应,将大分子转化为不饱和的小分子;
把煤转化为焦炉气、煤焦油和焦炭等,发生煤的干馏.
解答 解:乙烯与溴水反应,而乙烷不能,除杂试剂为溴水(A),分离方法为洗气(c);
溴与NaOH溶液反应后,与溴苯分层,则除杂试剂为NaOH溶液(B),分离方法为分液(b);
乙酸与碳酸钠溶液反应后,与乙酸乙酯分层,则除杂试剂为碳酸钠溶液(E),分离方法为分液(b);
水与CaO反应后,增大与乙醇的沸点差异,则除杂试剂为CaO(C),分离方法为蒸馏(a);
将重油转化为汽油,需要发生裂化反应,将大分子转化为不饱和的小分子,操作方法为g;
把煤转化为焦炉气、煤焦油和焦炭等,发生煤的干馏,操作方法为e,
故答案为:
| 组别 | 试剂 | 操作方法 |
| 1 | A | c |
| 2 | B | b |
| 3 | E | b |
| 4 | C | a |
| 5 | g | |
| 6 | e |
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意有机物的性质及分离方法,题目难度不大.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
5.下列电子式,正确的是( )
| A. | 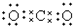 | B. | K+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$H]- | ||
| C. | 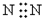 | D. |  |
2.已知甲苯的一氯代物的同分异构体共有4种,则甲基环己烷的一氯代物的同分异构体共( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
9.加热的条件下,铝与下列溶液作用产生H2的是( )
| A. | 浓硫酸 | B. | 浓硝酸 | C. | 稀硝酸 | D. | NaOH溶液 |
19.实验室制取下列各组气体时,发生装置和收集方法相同,且都能用浓硫酸干燥的是( )
| A. | SO2和H2S | B. | O2和NH3 | C. | CO2和H2 | D. | CH4和O2 |
6.10mL某气态烃,在50mL氧气中充分燃烧,得到液态水和35mL气体(气体体积均在同温同压下测定)此烃可能是( )
| A. | C2H6 | B. | C4H8 | C. | C3H8 | D. | C3H6 |
3.已知元素X、Y的核电荷数分别是a和b,它们的离子Xm+和Yn-的核外电子排布相同,则下列关系式正确的是( )
| A. | a=b+m-n | B. | a=b-m+n | C. | a-m=b+n | D. | a-m=b-n |
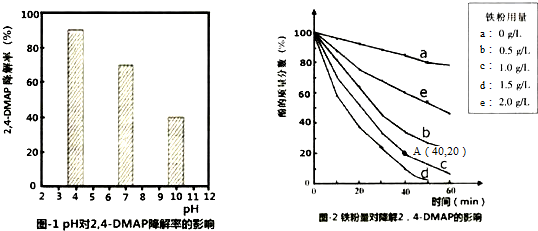
18.利用Na2S2O8产生的强氧化性SO4-•(自由基)降解有机污染物是目前最具潜力的高级氧化技术.文献报道某课题组探究pH,单质铁和Na2S2O8的浓度对降解2,4-DMAP(2,4--甲基苯酚)效率的影响.
(1)探究溶液酸碱性的影响:将等量的2,4-DMAP加入到不同pH的Na2S2O8溶液中,结果如图1所示.由此可知:溶液酸性增强,有利于 (填“有利于”或“不利于”)Na2S2O8产生SO4-•.
(2)探究铁粉用量的影响:
①实验前,先用0.1mol•L-1 H2SO4洗涤Fe粉,其目的是去除铁粉表面的氧化物等杂质,后用蒸馏水洗涤至中性;
②相同条件下,取不同量处理后的铁粉分别加入c(2,4-DMAP)=1.0×10 -3mol•L-1、c(Na2S2O8)=4.2×10-3mol•L-1的混合溶液中,实验结果如图2所示.其中降解效率最好的铁粉用量是1.5g/L;计算从反应开始到A点时,2,4-DMAP降解的平均反应速率为2.0×10-5mol/(L•min)(忽略反应过程中溶液总质量变化).
③已知:2Fe+O2+2H2O=2Fe2++4OH-,S2O8-+Fe2+=SO4-+SO42-+Fe3+此外还可能会发生:SO4-+Fe2+=SO42-+Fe3+.当铁粉加入量过大时,2,4-DMAP的降解率反而下降,原因可能是(用离子方程式表示).Fe+2Fe3+=3Fe2+,SO4-+Fe2+=SO42-+Fe3+.
(3)探究Na2S2O8浓度的影响:填写下表中空格,完成实验方案.
(1)探究溶液酸碱性的影响:将等量的2,4-DMAP加入到不同pH的Na2S2O8溶液中,结果如图1所示.由此可知:溶液酸性增强,有利于 (填“有利于”或“不利于”)Na2S2O8产生SO4-•.
(2)探究铁粉用量的影响:
①实验前,先用0.1mol•L-1 H2SO4洗涤Fe粉,其目的是去除铁粉表面的氧化物等杂质,后用蒸馏水洗涤至中性;
②相同条件下,取不同量处理后的铁粉分别加入c(2,4-DMAP)=1.0×10 -3mol•L-1、c(Na2S2O8)=4.2×10-3mol•L-1的混合溶液中,实验结果如图2所示.其中降解效率最好的铁粉用量是1.5g/L;计算从反应开始到A点时,2,4-DMAP降解的平均反应速率为2.0×10-5mol/(L•min)(忽略反应过程中溶液总质量变化).
③已知:2Fe+O2+2H2O=2Fe2++4OH-,S2O8-+Fe2+=SO4-+SO42-+Fe3+此外还可能会发生:SO4-+Fe2+=SO42-+Fe3+.当铁粉加入量过大时,2,4-DMAP的降解率反而下降,原因可能是(用离子方程式表示).Fe+2Fe3+=3Fe2+,SO4-+Fe2+=SO42-+Fe3+.
(3)探究Na2S2O8浓度的影响:填写下表中空格,完成实验方案.
| 序号、物理量 | M(Fe粉)/g | V[0.05mol.L-1Na2S2O8]/mL | V[H2O]/mL | 收集数据和得出结论 | |
| 1 | 100 | 0.3 | 50 | 50 | |
| 2 | 100V(污水)/mL | 0.3 |

 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,回答下列问题: