题目内容
现有含0.04 mol的AlCl3和0.06 mol的FeCl3的混合溶液110 mL,向其中加入4 mol/L的NaOH溶液90 mL,使其充分反应(假设反应后溶液的体积为两者体积之和).
(1)所得沉淀物质的量为多少?
(2)溶液中除Na+,Cl-外其它离子物质的量浓度各为多少?
答案:
解析:
解析:
|
(1)解:n(NaOH)=0.09L×4mol/L=0.36mol (1分) Al3++4OH- 0.04mol 0.16mol 0.04mol Fe3++3OH- 0.06mol 0.18mol 0.06mol ∵0.16mol+0.18mol=0.34mol<0.36mol ∴沉淀Fe(OH)3物质的量为0.06mol (3分) (2)多余OH-物质的量:n(OH-)=0.36mol-0.34mol=0.02mol c(OH-)=0.02mol/(0.11L+0.09L)=0.1mol/L (2分) c(AlO2-)=0.04mol/(0.11L+0.09L)=0.2mol/L (2分) |

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
 4N2+6H2O 6NO2+8NH3
4N2+6H2O 6NO2+8NH3 含钡化合物在实验室和工业生产中都有广泛的用途.
含钡化合物在实验室和工业生产中都有广泛的用途. 2BaO2.现有16.0吨的氧化钡在足量的氧气中加热反应后,固体的质量变为17.6吨.那么实际参加反应的氧化钡的质量为______吨.
2BaO2.现有16.0吨的氧化钡在足量的氧气中加热反应后,固体的质量变为17.6吨.那么实际参加反应的氧化钡的质量为______吨.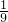 ,求该反应条件下混合气体的平均式量?
,求该反应条件下混合气体的平均式量?