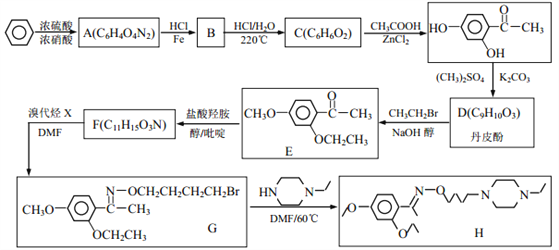
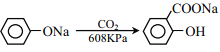
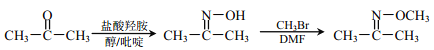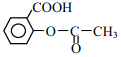题目内容
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )

A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
【答案】B
【解析】t0~t1阶段,A 的浓度变化为0.15-0.06=0.09 mol·L-1,t0~t1阶段的平均反应速率为0.09/15=0.006 mol·L-1·s-1, A错误;t1时该反应达到平衡, A 的转化率为=0.09/0.15×100=60%, B正确;根据反应3A(g) ![]() B(g)+2C(g)可知,反应达平衡后,c(A)=0.09 mol·L-1, c(B)=O.03 mol·L-1,由图像可知反应达平衡后,c(B)=0.05 mol·L-1,所以B的起始的浓度为0.02 mol·L-1,B的起始的物质的量为0.02×2=0.04 mol,C错误;t0~t1 阶段,c(A)=0.09 mol·L-1,n(A)=0.09×2=0.18 mol,此时放热a kJ,如果有3 mol A完全反应,放热为50 a /3 kJ,即3A(g)
B(g)+2C(g)可知,反应达平衡后,c(A)=0.09 mol·L-1, c(B)=O.03 mol·L-1,由图像可知反应达平衡后,c(B)=0.05 mol·L-1,所以B的起始的浓度为0.02 mol·L-1,B的起始的物质的量为0.02×2=0.04 mol,C错误;t0~t1 阶段,c(A)=0.09 mol·L-1,n(A)=0.09×2=0.18 mol,此时放热a kJ,如果有3 mol A完全反应,放热为50 a /3 kJ,即3A(g)![]() B(g)+2C(g) ΔH=-50a/3 kJ·mol-1, D错误;正确选项B。
B(g)+2C(g) ΔH=-50a/3 kJ·mol-1, D错误;正确选项B。

 阅读快车系列答案
阅读快车系列答案【题目】(1)肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。肼燃料电池原理如图所示,通入氧气的电极上发生的电极反应式为____________________。

(2)在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①到达平衡时NO的转化率为_________。
②用O2表示从0~2 s内该反应的平均速率v=____________________。
③如下图所示,表示NO2变化曲线的是________。

④能说明该反应已达到平衡状态的是________(填序号)。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内的密度保持不变