题目内容
13.有机物A由C、H、O元素组成,为研究A组成与结构,进行如下实验,称取A10.4g,升温使其气化,测气密度是相同条件下H2的52倍,将此10.4g,A在一定O2中燃烧,产物经过足量浓硫酸后,浓硫酸的质量增加7.2g,在通过灼热氧化铜充分反应后,固体质量减轻3.2g.最后气体在通过碱石灰被完全吸收,碱石灰质量增加17.6g,有机物A可发生酯化反应生成六圆环的酯b,b的核磁共振氢谱中只有一种峰.(1)有机物A的相对分子式质量104.
(2)A的分子式C4H8O3.
(3)A的结构简式
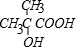 ;b 的结构简式
;b 的结构简式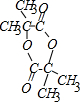 .
.
分析 (1)同温同压下,气体的密度之比等于相对分子质量之比,据此计算A的相对分子式质量;
(2)浓硫酸增重的为水的质量,碱石灰增重的质量为二氧化碳的质量,再根据n=$\frac{m}{M}$计算10.4gA、7.2g水和17.6g二氧化碳的物质的量,进而计算有机物中C原子、H原子的物质的量与二者质量之和,再计算O原子的质量与物质的量,结合相对分子质量计算确定分子式;
(3)有机物A可发生酯化反应生成六元环的酯b,A中含有1个羧基和1个羟基,b的核磁共振氢谱中只有一种峰,b中只有1种等效H,说明b具有对称结构,则A中所有侧链H都完全相同,据此确定A的结构简式和b的结构简式.
解答 解:(1)该有机物蒸汽密度是相同条件下H2的52倍,则有机物的相对分子质量为:52×2=104,
故答案为:104;
(2)浓硫酸增重7.2g为生成的水的质量,水的物质的量为:$\frac{7.2g}{18g/mol}$=0.4mol,则10.4g有机物中含有0.8molH原子,
在通过灼热氧化铜充分反应后,固体质量减轻3.2g,一氧化碳转化成二氧化碳,最后气体在通过碱石灰被完全吸收,碱石灰质量增加17.6g,碱石灰增重的为二氧化碳的质量,则二氧化碳的物质的量为:$\frac{17.6g}{44g/mol}$=0.4mol,根据碳原子守恒,10.4g该有机物中含有0.4molC原子,
10.4g该有机物的物质的量为:$\frac{10.4g}{104g/mol}$=0.1mol,有机物A分子中含有C、H原子数为:N(C)=$\frac{0.4mol}{0.1mol}$=4、N(H)=$\frac{0.8mol}{0.1mol}$=8,有机物A的相对分子质量为104,则A中含有O原子数为:N(O)=$\frac{104-12×4-1×8}{16}$=3,
所以有机物A的分子式为:C4H8O3,
故答案为:C4H8O3;
(3)有机物A可发生酯化反应生成六元环的酯b,则A分子中含有1个-OH和1个-COOH;b的核磁共振氢谱中只有一种峰,则b中只有1种等效H原子,说明b具有对称结构,则A中所有侧链H的都完全等效,结合A的分子式C4H8O3可知,A中应该含有2个甲基,且两个甲基连接在同一个C上,则A的结构简式为: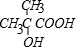 ,b为两分子A通过酯化反应生成的,则b的结构简式为:
,b为两分子A通过酯化反应生成的,则b的结构简式为: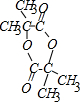 ,
,
故答案为: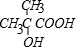 ;
;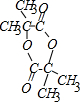 .
.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,注意掌握质量守恒定律在确定有机物分子式中的应用,(3)为难点,需要明确常见有机物结构与性质.

| A. | 分馏 | B. | 裂化 | C. | 裂解 | D. | 干馏 |
| A. | 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和(a+1),则有c1=10c2. | |
| B. | 10mL0.1mol•L-1CH3COOH溶液加入等物质的量的NaOH后,溶液中有c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | 在0.1mol•L-1NaHSO3溶液中有c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3) | |
| D. | pH<7的某二元弱酸是酸式盐NaHA溶液中有c(H+)+2c(A2-)=c(OH-)+c(H2A) |
| A. | 1 molCaC2晶体中含有的离子总数为3NA | |
| B. | 常温常压下,3g-CH3中含有的电子数为1.8NA | |
| C. | NA个HCl分子与22.4LH2和Cl2的混合气体所含有的原子数均为2NA | |
| D. | 80 mL 12 mol/L的浓盐酸与足量MnO2反应,生成的Cl2分子数目为0.48 NA |
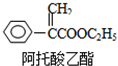
| A. | 能使高锰酸钾褪色,不能使溴水褪色 | |
| B. | 1mol阿托酸乙酯最多能与5mol H2加成 | |
| C. | 能发生加成、加聚、氧化、水解等反应 | |
| D. | 分子式为C11H13O2 |
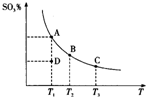 二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法正确的是( )
二氧化硫的催化氧化原理为2SO2(g)+O2(g)?2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如图所示.下列说法正确的是( )| A. | 在D点时,反应逆向进行 | |
| B. | 反应2SO2(g)+O2(g)?2SO3(g)的△H>0 | |
| C. | 若B、C点的平衡常数分别为KB、KC,则KB>KC | |
| D. | 恒温恒压下向平衡体系中通入氦气,平衡向左移动 |
 按如图所示装置进行铁与水的反应实验,请回答下列问题:
按如图所示装置进行铁与水的反应实验,请回答下列问题: