题目内容
在一定温度,一定体积密闭容器中,对于可逆反应A(g)+3B(g)?2C(g),下列叙述能说明已达到平衡的是( )
| A、容器内混合气体的密度不发生变化 |
| B、容器内的压强不再变化 |
| C、单位时间内消耗amolA,同时生成2amolC |
| D、B的反应速率是A的反应速率的3倍 |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答:
解:A、m、V不变,混合气体的密度始终不变化,故A错误;
B、反应前后气体体积不相同,体系的压强不再变化,说明气体总物质的量不变,反应达到平衡状态,故B正确;
C、消耗A和生成C都是正向进行的反应,其速率之比等于化学计量数之比,不能说明反应达到平衡状态,故C错误;
D、反应速率之比始终等于化学计量数之比,看不出正逆反应速率相等,故D错误;
故选B.
B、反应前后气体体积不相同,体系的压强不再变化,说明气体总物质的量不变,反应达到平衡状态,故B正确;
C、消耗A和生成C都是正向进行的反应,其速率之比等于化学计量数之比,不能说明反应达到平衡状态,故C错误;
D、反应速率之比始终等于化学计量数之比,看不出正逆反应速率相等,故D错误;
故选B.
点评:本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
下列叙述正确的是( )
| A、加热煮沸MgCO3悬浊液,最终得到Mg(OH)2沉淀,说明Ksp(MgCO3)<Ksp[Mg(OH)2] |
| B、因为NH3的水溶液可以导电,所以NH3是电解质 |
| C、向污水中投入明矾,生成能凝悬浮物的胶体 |
| D、90℃水的离子积Kw=3.8×10-13,此时水的pH<7,溶液呈酸性 |
下列叙述不正确的是( )
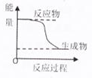

| A、化学平衡发生移动,平衡常数不一定发生变化 |
| B、升高温度会增大化学反应速率,其原因是增加了活化分子的百分数 |
| C、某化学反应的能量变化如图所示,则反应的△H>0 |
| D、电解熔融Al2O3是将部分电能转化为化学能 |
下列有关化学基本概念判断的依据正确的是( )
| A、电解质:熔解状态能否导电 |
| B、共价化合物:化合晶体中是否含有共价键 |
| C、离子化合物:化合物晶体中是否含有离子键 |
| D、强弱电解质:溶液的导电能力大小 |
2SO2+O2?2SO3是接触法制硫酸工艺中的一个重要反应,下列关于该反应的说法中错误的是( )
| A、增加SO2的浓度能加快该反应的速率 |
| B、反应过程中SO2能全部转化为SO3 |
| C、降低体系温度会减慢该反应的速率 |
| D、使用催化剂能改变该反应的速率 |
在某一化学反应,0.5L的密闭容器中,反应物B的物质的量在5s内从2.0mol变成0.5mol,在这5s内B的化学反应速率为( )
| A、3mol/L |
| B、0.3mol/L?s |
| C、0.6mol/L?s |
| D、0.1mol/L?s |
