题目内容
7.下列说法正确的是( )| A. | 分子晶体中分子间作用力越大,分子越稳定 | |
| B. | 硫酸氢钠溶于水时只破坏离子键 | |
| C. | 含有阳离子的晶体中一定有阴离子 | |
| D. | 1 mol二氧化硅晶体含4 mol Si-O键 |
分析 A.分子晶体的稳定性与化学键有关;
B.钠离子和硫酸根是离子键.氢离子和硫酸根是共价键;
C.阳离子的晶体不一定含阴离子;
D.根据二氧化硅的结构计算Si-O键的物质的量.
解答 解:A.分子晶体的稳定性与化学键有关,共价键越强,稳定性越大,而分子间作用力只影响物质的熔沸点,故A错误;
B.钠离子和硫酸根是离子键.氢离子和硫酸根是共价键,硫酸氢钠溶于水既有共价键破坏又有离子键破坏,故B错误;
C.阳离子的晶体不一定含阴离子,如金属晶体中含金属阳离子和自由电子,故C错误;
D.一个Si原子能和4个O原子形成4个共价键使Si原子达到稳定结构,所以1mol二氧化硅晶体中含Si-O键为4mol,故D正确.
故选D.
点评 本题考查较综合,涉及晶体类型及作用力、化学键和化合物的关系等,为高频考点,把握相关概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.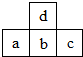 图为周期表中短周期的一部分.若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )
图为周期表中短周期的一部分.若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )
 图为周期表中短周期的一部分.若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )
图为周期表中短周期的一部分.若a原子最外层电子数比次外层电子数少3个,则下列说法中不正确的是( )| A. | 原子半径的大小顺序是c>b>a>d | |
| B. | c的氢化物比a的氢化物稳定 | |
| C. | b和d可结合成bd32-和bd42-阴离子 | |
| D. | a、b、c的最高价氧化物对应水化物的酸性强弱关系是c>b>a |
12.对于工业合成氨反应:N2+3H2$?_{催化剂}^{高温高压}$2NH3,下列说法错误的是( )
| A. | 使用合适的催化剂可以加大反应速率 | |
| B. | 升高温度可以增大反应速率 | |
| C. | 增大N2浓度可以使H2转化率达到100% | |
| D. | 增大N2浓度可以增大反应速率 |
19.用铁片与稀硫酸反应时,下列措施不能使反应速率加快的是( )
| A. | 加热 | B. | 滴加少量的CuSO4溶液 | ||
| C. | 不用稀硫酸,改用98%浓硫酸 | D. | 不用铁片,改用铁粉 |
17.反应A+3B=2C+2D在不同条件下反应速率如下,其中最快的是( )
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.6mol/(L•min) | ||
| C. | v(C)=0.4mol/(L•min) | D. | v(D)=0.0075 mol/(L•s) |
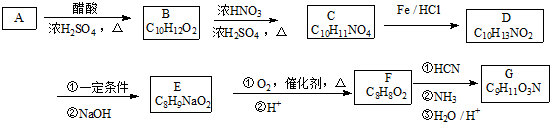
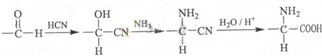
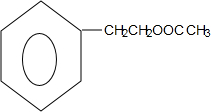 +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$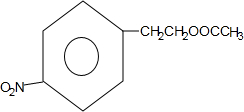 +H2O.
+H2O.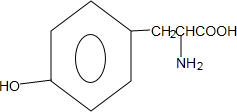 .
.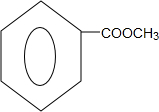 .
.
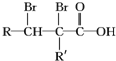 ,A的化学式是C14H18O,A可以发生的反应是aef(填写序号字母).
,A的化学式是C14H18O,A可以发生的反应是aef(填写序号字母).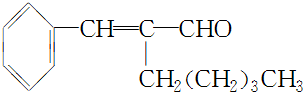 .
. +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH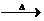
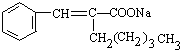 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.