题目内容
【题目】为了证明一水合氨(NH3H2O)是弱电解质,常温下做以下实验没有意义的是
A.用pH试纸测得0.010 mol/L氨水的pH为10
B.用pH试纸测得0.10mol/L NH4Cl溶液的pH<7
C.比较浓度均为 0.1 mol·L-1NaOH溶液和氨水的导电能力
D.取10mL 0.010mol/L氨水,滴入2滴酚酞,显粉红色,再滴加少量稀盐酸,颜色变浅
【答案】D
【解析】
一水合氨是弱电解质,氨水的电离方程式为:NH3H2O ![]() NH4++OH-,证明一水合氨是弱电解质,需证明一水合氨的电离是部分电离,据此分析。
NH4++OH-,证明一水合氨是弱电解质,需证明一水合氨的电离是部分电离,据此分析。
A.0.010mol/L氨水的pH为10,OH-浓度为10-4mol/L,说明一水合氨的电离是部分电离,A不选;
B.0.10mol/LNH4Cl溶液为pH<7,说明氯化铵是强酸弱碱盐,B不选;
C.比较浓度均为 0.1 mol·L-1NaOH溶液和氨水的导电能力,氨水的导电能力弱于NaOH溶液,说明一水合氨为弱电解质,C不选;
D.向氨水中加入盐酸发生了中和反应,不能证明一水合氨是弱电解质,D选。
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如图,其中配位键和氢键均釆用虚线表示。
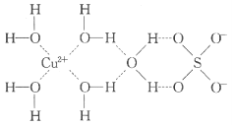
(1)写出基态Cu原子的核外电子排布式____,S原子的价层电子排布图______
(2)写出胆矾晶体中水合铜离子的结构简式_____(必须将配位键表示出来)。
(3)向CuSO4溶液中滴加氨水,可以得到深蓝色的溶液,再加入乙醇后析出深蓝色晶体,写出深蓝色晶体的化学式_____。比较NH3和[Cu(NH3)4]2+中H-N-H 中键角的大小:NH3_____[Cu(NH3)4]2+(填“![]() ” “
” “![]() ” 或“=”)。
” 或“=”)。
(4)已知H2O2的结构如图:
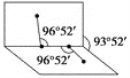
H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′,估计它难溶于CS2,简要说明原因______。
(5)分析下表中两种物质的键能数据(单位:kJ/mol)。
A—B | A=B |
| |
CO | 357.7 | 798.9 | 1 071.9 |
N2 | 154.8 | 418.4 | 941.7 |
结合数据说明CO比N2活泼的原因:_________。