题目内容
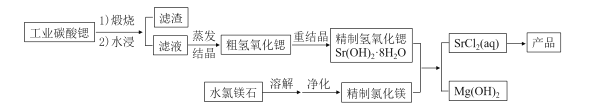
【题目】一种“氢氧化锶-氯化镁法”制备“牙膏用氯化锶(SrCl2·6H2O)”的工艺流程如图:
(1)锶与钙同主族。金属锶应保存在__中(填“水”、“乙醇”或“煤油”)。
(2)天青石(主要成分SrSO4)经过多步反应后可制得工业碳酸锶。其中第一步是与过量焦炭隔绝空气微波加热还原为硫化锶,该过程的化学方程式为___。
(3)工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质。“滤渣”的主要成分是___。
(4)“重结晶”时蒸馏水用量[以质量比m(H2O):m(SrO)表示]对Sr(OH)2·8H2O纯度及产率的影响如下表。最合适的质量比为___,当质量比大于该比值时,Sr(OH)2·8H2O产率减小,其原因是___。
质量mH2O:mSrO | 4:1 | 5:1 | 6:1 | 7:1 | 8:1 | 9:1 | 10:1 |
Sr(OH)2·8H2O纯度% | 98.64 | 98.68 | 98.65 | 98.64 | 98.63 | 98.63 | 98.65 |
Sr(OH)2·8H2O产率% | 17.91 | 53.36 | 63.50 | 72.66 | 92.17 | 89.65 | 88.93 |
(5)水氯镁石是盐湖提钾后的副产品,其中SO42-含量约为1%,“净化”过程中常使用SrCl2除杂,写出该过程的离子方程式___
(6)若需进一步获得无水氯化锶,必须对SrCl2·6H2O(M=267g·mol-1)进行脱水。脱水过程采用烘干法在170℃下预脱水,失重达33.7%,此时获得的产物化学式为___。
【答案】煤油 SrSO4+4C![]() SrS+4CO↑ Ca(OH)2、MgO 8:1 随着蒸馏水溶剂的增加,在冷却结晶、过滤的过程中部分氢氧化锶留在母液中导致产率减小 SO42-+Sr2+=SrSO4↓ SrCl2·H2O
SrS+4CO↑ Ca(OH)2、MgO 8:1 随着蒸馏水溶剂的增加,在冷却结晶、过滤的过程中部分氢氧化锶留在母液中导致产率减小 SO42-+Sr2+=SrSO4↓ SrCl2·H2O
【解析】
一种“氢氧化锶-氯化镁法”制备“牙膏用氯化锶(SrCl26H2O)”,由流程可知,工业碳酸锶隔绝空气高温焙烧后水浸过滤,将滤液蒸发浓缩,冷却结晶得粗氢氧化锶,再通过重结晶操作,可得精制的氢氧化锶Sr(OH)28H2O,与由水氯镁石提纯而得的精制氯化镁发生复分解反应生成SrCl2溶液和Mg(OH)2沉淀,滤液中含SrCl2,最后蒸发、冷却结晶得到SrCl26H2O,由此分析解答。
(1)金属锶很活泼,易与水中的氢发生置换反应和醇羟基中氢发生置换反应,所以可保存在煤油中;
(2)此过程中硫酸锶与碳在高温下反应生成硫化锶和一氧化碳,反应方程式为SrSO4+4C![]() SrS+4CO↑;
SrS+4CO↑;
(3)工业碳酸锶中含有CaCO3、MgCO3、BaCO3等杂质,煅烧后生成对应氧化物,氧化物和水反应生成氢氧化物,MgCO3煅烧后得到的MgO不溶于水,也不与水反应,而氢氧化钙微溶于水,“滤渣”的主要成分是MgO和Ca(OH)2;
(4)题给信息中Sr(OH)28H2O纯度都已经达到98%以上,产率是在质量比mH2O:mSrO=8:1时最高为92.17%,当质量比大于该比值时,Sr(OH)28H2O产率减小,其原因是随着蒸馏水溶剂的增加,在冷却结晶过滤的过程中部分Sr(OH)2留在母液中导致产率降低;
(5)水氯镁石是盐湖提钾后的副产品,其中SO42含量约为1%,“净化”过程中常使用SrCl2 除杂,该过程的离子方程式为SO42-+Sr2+=SrSO4↓;
(6)脱水过程采用烘干法在170℃下预脱水,失重达33.7%,设烘干法在170℃下脱去x个结晶水,则![]() ×100%=33.7%,x=5,即SrCl2·6H2O脱水失去5个结晶水,故此时获得的产物化学式为:SrCl2H2O。
×100%=33.7%,x=5,即SrCl2·6H2O脱水失去5个结晶水,故此时获得的产物化学式为:SrCl2H2O。