题目内容
 与
与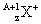 的两种微粒,下列叙述正确的是( )
的两种微粒,下列叙述正确的是( )| A.一定都是由质子、中子、电子组成的 |
| B.化学性质几乎完全相同 |
| C.核电荷数和核外电子数一定相等 |
| D.质子数一定相同,质量数和中子数一定不相同 |
D
试题分析:A如
 只有质子、电子两种微粒构成。错误。B.前者是原子,后者是阳离子,化学性质不相同。错误。C.核电荷数相同,而核外电子数不相等。错误。D.质子数一定相同,质量数前者小,而中子数后者大。二者不一定相同。正确。
只有质子、电子两种微粒构成。错误。B.前者是原子,后者是阳离子,化学性质不相同。错误。C.核电荷数相同,而核外电子数不相等。错误。D.质子数一定相同,质量数前者小,而中子数后者大。二者不一定相同。正确。
练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
题目内容
 与
与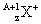 的两种微粒,下列叙述正确的是( )
的两种微粒,下列叙述正确的是( )| A.一定都是由质子、中子、电子组成的 |
| B.化学性质几乎完全相同 |
| C.核电荷数和核外电子数一定相等 |
| D.质子数一定相同,质量数和中子数一定不相同 |
 只有质子、电子两种微粒构成。错误。B.前者是原子,后者是阳离子,化学性质不相同。错误。C.核电荷数相同,而核外电子数不相等。错误。D.质子数一定相同,质量数前者小,而中子数后者大。二者不一定相同。正确。
只有质子、电子两种微粒构成。错误。B.前者是原子,后者是阳离子,化学性质不相同。错误。C.核电荷数相同,而核外电子数不相等。错误。D.质子数一定相同,质量数前者小,而中子数后者大。二者不一定相同。正确。
 应用题作业本系列答案
应用题作业本系列答案