题目内容
8.下列说法中正确的是( )| A. | 2mol水的摩尔质量是1mol 水的摩尔质量的2倍 | |
| B. | 阿伏伽德罗常数就是6.02×1023 | |
| C. | 6.02×1023 mol-1叫做阿伏伽德罗常数 | |
| D. | 科学上规定含6.02×1023个粒子的任何粒子集合体计量为1mol |
分析 A.根据摩尔质量的定义分析,水的摩尔质量为18g/mol;
B.阿伏加德罗常数近似为6.02×1023 mol-1;
C.单位物质的量的物质含有的粒子数叫做阿伏伽德罗常数;
D.依据1mol的规定分析.
解答 解:A.摩尔质量是指单位物质的量的物质所具有的质量,相同分子的摩尔质量相等,2mol水的摩尔质量是1mol水摩尔质量相等,均是18g/mol,故A错误;
B.阿伏伽德罗常数NA≈6.02×1023mol-1,故B错误;
C.6.02×1023 mol-1为阿伏加德罗常数近似值,故C错误;
D.把12g12C中所含碳原子数规定为1mol,近似为6.02×1023/mol,称为阿伏伽德罗常数,是微观粒子的集合体,故D正确,
故选D.
点评 本题考查了物质的量概念和单位的理解和应用,注意阿伏伽德罗常数的规定,物质的量是描述微观粒子的物理量,题目较简单.

练习册系列答案
相关题目
18.下列家庭小实验不能制得溶液的是( )
| A. | 食盐+水 | B. | 泥土+水 | C. | 植物油+汽油 | D. | 蔗糖+水 |
19.下列物质属于纯净物的是( )
| A. | 高锰酸钾完全分解后的残留物 | B. | 洁净的食盐水 | ||
| C. | 冰、水混合物 | D. | 含氮30%的硝酸铵(NH4NO3) |
16.在铜和浓H2SO4的反应中,如果电子转移0.4mol,则被还原的硫酸的物质的量是( )
| A. | 0.4mol | B. | 0.2mol | C. | 2mol | D. | 4mol |
3.N2中混有少量CO2气体和水蒸气,除去的正确操作是( )
| A. | 通过无水氯化钙的干燥管 | |
| B. | 通过浓硫酸的洗气瓶 | |
| C. | 先通过氢氧化钠溶液的洗气瓶,再通过浓硫酸的洗气瓶 | |
| D. | 先通过浓硫酸的洗气瓶,再通过氢氧化钠溶液的洗气瓶 |
13.下列物质中所含原子数按从多到少的顺序排列正确的是( )
①0.5mol NH3 ②标准状况下22.4L He ③4℃时18mL水 ④0.8mol H3PO4.
①0.5mol NH3 ②标准状况下22.4L He ③4℃时18mL水 ④0.8mol H3PO4.
| A. | ①④③② | B. | ④③②① | C. | ②③④① | D. | ④③①② |
20.下列各组混合物中,不能通过分液的方法进行分离的是( )
| A. | 酒精和水 | B. | 植物油和水 | C. | 汽油和水 | D. | 四氯化碳和水 |
18.将5mol/L MgCl2溶液a mL稀释至b mL,稀释后溶液中Cl-的物质的量浓度为( )
| A. | $\frac{5a}{b}$ mol/L | B. | $\frac{10a}{b}$ mol/L | C. | $\frac{b}{5a}$ mol/L | D. | $\frac{a}{b}$ mol/L |
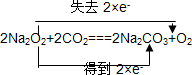 、
、 、2aOH+CO2=Na2CO3+H2O.
、2aOH+CO2=Na2CO3+H2O.