题目内容
【题目】将![]() 和
和![]() 置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为
置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为![]() 体系中存在以下反应关系:
体系中存在以下反应关系:![]()
![]()
![]()
![]()
回答下列问题:
(1)![]() 与
与![]() 、
、![]() 、
、![]() 的关系是______。
的关系是______。
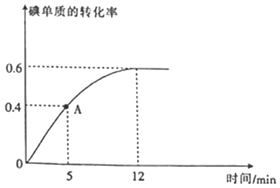
(2)![]() 反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时
反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ,前
,前![]() 的生成速率
的生成速率![]() ______。
______。
(3)达到平衡状态时,氢气的物质的量分数是______;![]() ______;
______;![]() ______
______![]() 保留2位有效数字
保留2位有效数字![]() 为用平衡分压代替浓度表示的平衡常数,平衡分压
为用平衡分压代替浓度表示的平衡常数,平衡分压![]() 总压强
总压强![]() 物质的量分数
物质的量分数![]() 。
。
(4)下列说法能说明该体系达到平衡状态的是______。
A.颜色不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.温度不再变化
(5)![]() 是一种强酸,常温下将
是一种强酸,常温下将![]() 的HI溶液和
的HI溶液和![]() 的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
的氨水等体积混合后,溶液呈中性。此时溶液中离子浓度的大小关系是______。
【答案】![]()
![]()
![]()
![]() 9
9 ![]() AD
AD ![]()
【解析】
(1)![]() ,
,![]() ,
,![]()
![]() ,根据盖斯定律
,根据盖斯定律![]() 计算
计算![]() 的焓变
的焓变![]() ;
;
(2)由图可知,A点时反应正向进行,碘单质的转化率为![]() ,则
,则![]() ,根据
,根据![]() 计算
计算![]() ,结合反应的速率之比等于计量数之比求出
,结合反应的速率之比等于计量数之比求出![]() ;
;
(3)根据反应三段式计算达到平衡状态时氢气的物质的量,将平衡分压代入![]() 表达式
表达式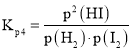 中计算
中计算![]() ;由于反应
;由于反应![]() ,即
,即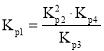 ,则
,则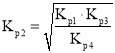 ;
;
(4)反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(5)![]() 是一种强酸,一水合氨是弱碱,常温下将
是一种强酸,一水合氨是弱碱,常温下将![]() 的HI溶液和 a
的HI溶液和 a ![]() 的氨水等体积混合后,溶液呈中性,此时溶质为
的氨水等体积混合后,溶液呈中性,此时溶质为![]() ,因为溶液呈中性,则
,因为溶液呈中性,则![]() ,所以
,所以![]() ,据此进行分析。
,据此进行分析。
(1)![]()
![]()
![]()
![]()
根据盖斯定律![]() 计算
计算![]() 的焓变
的焓变![]() ,即
,即![]() ,
,
故答案为:![]() ;
;
(2)由图可知,A点时反应正向进行,即![]() ;碘单质的转化率为
;碘单质的转化率为![]() ,则
,则![]() ,
,![]() ,由
,由![]() 可知
可知![]() ,
,
故答案为:![]() ;
;![]() ;
;
(3)反应三段式

则达到平衡状态时,氢气的物质的量分数![]() ;
;
平衡分压![]() 、
、![]() ,所以
,所以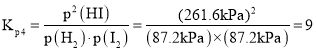 ;
;
由于反应![]() ,则
,则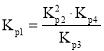 ,则
,则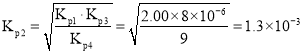 ,
,
故答案为:![]() ;9;
;9;![]() ;
;
(4)A.反应达平衡前,气体颜色在变,颜色不再变化,则说明反应达平衡,故A正确;
B.由于此反应的反应物和生成物均为气体,即体系中气体的总质量不变,而此反应前后气体的物质的量也不变,所以气体的平均相对分子质量始终不变,即不能说明反应体系达到平衡状态,故B错误;
C.由于反应物均为气体,且反应前后质量守恒,且容器为恒容的容器,所以气体密度始终不变,即气体密度不变不能说明反应是否达平衡,故C错误;
D.化学变化过程中伴随着能量的变化,所以温度不再变化说明反应体系达到平衡状态,故D正确,
故选:AD;
(5)![]() 是一种强酸,一水合氨是弱碱,常温下将
是一种强酸,一水合氨是弱碱,常温下将![]() 的HI溶液和 a
的HI溶液和 a ![]() 的氨水等体积混合后,溶液呈中性即
的氨水等体积混合后,溶液呈中性即![]() ,电荷守恒关系为
,电荷守恒关系为![]() ,则
,则![]() ,故以
,故以![]() ,
,
故答案为:![]() 。
。