题目内容
在400℃,1×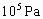 时将
时将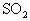 与
与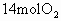 压入一个装有催化剂的1L密闭容器中(装有催化剂),发生
压入一个装有催化剂的1L密闭容器中(装有催化剂),发生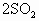 (g)+
(g)+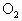 (g)
(g)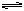
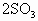 (g)的反应(该反应为放热反应),并且在10分钟后达到平衡时测得容器内有
(g)的反应(该反应为放热反应),并且在10分钟后达到平衡时测得容器内有 .
.
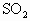 的起始浓度为________,
的起始浓度为________,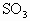 平衡时的浓度为________,
平衡时的浓度为________,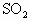 的转化率为________,
的转化率为________,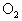 的平均速度为________,平衡时
的平均速度为________,平衡时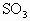 (g)占总体积的百分数为________,此时体系的压强为起始时体系压强的________倍.
(g)占总体积的百分数为________,此时体系的压强为起始时体系压强的________倍.
答案:
解析:
解析:
|
6mol/L,4mol/L,66.7%,0.2mol/(L·S),22%,0.9 |

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
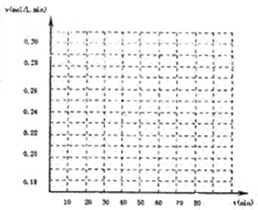
(1)下表为某温度和压强下,密闭容器中SO2氧化为SO3反应在不同时间各物质的浓度(mol/L)
试画出V(SO3)-t图.

(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7%,O2:11%,N2:82%):
①如何利用表中数据推断SO2的氧化反应的热效应?______.
②在400一500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:______.
③工业制硫酸所产生的尾气含有SO2、微量的SO3和酸雾.为了保护环境将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:______.
④能用于测定硫酸尾气中SO2含量的是______.(填字母)
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液
⑤某温度下,SO2氧化为SO3在10L的密闭容器中进行,开始向容器加入4.0mol SO2和10.0mo1O2,当反应达到平衡时,混合气体为13.0mol,则SO2的转化率为______,该温度反应的平衡常数______.
| 时间(min) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| SO2 | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 |
| O2 | 5 | 3.5 | 2.5 | 1.75 | 1 | 0.5 | 0.5 | 0.5 |
| SO3 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 |

(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7%,O2:11%,N2:82%):
| 压强/MPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
②在400一500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:______.
③工业制硫酸所产生的尾气含有SO2、微量的SO3和酸雾.为了保护环境将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:______.
④能用于测定硫酸尾气中SO2含量的是______.(填字母)
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液
⑤某温度下,SO2氧化为SO3在10L的密闭容器中进行,开始向容器加入4.0mol SO2和10.0mo1O2,当反应达到平衡时,混合气体为13.0mol,则SO2的转化率为______,该温度反应的平衡常数______.
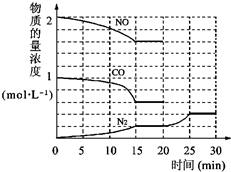 中NO(g)、CO(g)、N2(g)的物质的量浓度变化如图所示,则反应进行到15min时,NO的平均反应速率为
中NO(g)、CO(g)、N2(g)的物质的量浓度变化如图所示,则反应进行到15min时,NO的平均反应速率为