题目内容
5.氨气是一种重要的物质,在国民经济中占有重要地位.(1)合成氨工业中,合成塔中每生成1mol NH3,放出46.1kJ热量.
①合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g),△H=-92.2KJ/mol.
②若在相同条件下投入amol N2和bmol H2,达平衡时,放出184.4kJ热量,则a>(填“>”、“<”或“=”)>2.
(2)下列有关合成氨的说法中正确的是D.
A.加入催化剂,是为降低反应的△H,提高反应速率
B.在较高温度下反应,是为提高反应物的平衡转化率
C.适当提高氮氢比,是为提高反应物的总能量,加快反应速率
D.选择高压,是为加快反应速率,并提高反应物平衡转化率
(3)合成氨原料中的H2可用甲烷与水蒸气在高温下反应制得.已知:Ⅰ.1mol物质完全燃烧生成常温下稳定氧化物的相关数据如下表:
| 物质 | △H(kJ/mol) |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
Ⅲ.2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
①CH4燃烧生成气态产物的热化学方程式是CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3kJ/mol.
②CH4和水蒸气在高温下反应得到CO和H2的热化学方程式是CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.1kJ/mol.
分析 (1)①N2和H2完全反应生成1molNH3放热46.1kJ热量,生成2mol氨气放热92.2KJ,依据热化学方程式书写得到;
②合成氨是可逆反应,放出184.4KJ热量应该有2mol氮气反应,据此分析;
(2)A.加入催化剂,能够降低反应的活化能,不影响反应的△H;
B.正反应放热,升温平衡逆向移动,反应物转化率降低;
C.适当提高氮氢比,是为提高氢气的转化率;
D.正反应是气体体积减小的反应,增大压强,能够加快反应速率,并提高反应物平衡转化率;
(3)根据燃烧热的概念来书写热化学方程式,然后运用盖斯定律来解答.
解答 解:(1)①N2(g)与H2(g)反应生成1mol NH3(g),放出46.1KJ热量,生成2mol NH3(g),放热92.2KJ,标注物质聚集状态和对应反应焓变写出热化学方程式为:N2(g)+3H2(g)=2NH3(g),△H=-92.2KJ/mol;
故答案为:N2(g)+3H2(g)=2NH3(g),△H=-92.2KJ/mol;
②据合成氨的热化学方程式可知,放出184.4KJ热量应该有2mol氮气反应,合成氨是可逆反应,反应物不能完全转化,所以加入氨气的物质的量必须多于2mol,
故答案为:>;
(2)A.加入催化剂,能够降低反应的活化能,不影响反应的△H,故A错误;
B.正反应放热,升温平衡逆向移动,反应物转化率降低,故B错误;
C.适当提高氮氢比,是为提高氢气的转化率,故C错误;
D.正反应是气体体积减小的反应,增大压强,能够加快反应速率,并提高反应物平衡转化率,故D正确;
故答案为:D;
(3)①1mol物质完全燃烧生成常温下稳定氧化物时放出的热量为燃烧热,水为液态,热化学方程式为CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol ①
H2O(g)═H2O(l)△H=44.0kJ/mol ②
根据盖斯定律:①-②×2得
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3kJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3kJ/mol;
②CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol ①
H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8KJ/mol ②
CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283KJ/mol ③
而H2O(g)═H2O(l)△H=44.0kJ/mol ④
根据盖斯定律:④+①-②×3-③,得
CH4(g)+H2O(g)═CO(g)+3H2(g)的△H=44KJ/mol-890.3KJ/mol+285.8KJ/mol×3+283KJ/mol=+206.1kJ/mol,
故答案为:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.1kJ/mol.
点评 本题主要考查热化学方程式书写、盖斯定律的应用以及化学平衡理论原理,应加强基础知识的学习,(3)中盖斯定律的应用为易错点.

| A. | Ca2+ | B. | K | C. | S2- | D. | K+ |
| A | B | C | D | |
| X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
| Y | FeCl3 | CuCl2 | Al | Na2CO3 |
| Z | Cl2 | Fe | NaOH溶液 | BaCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 8mL | B. | 10mL | C. | 15mL | D. | 23.75mL |
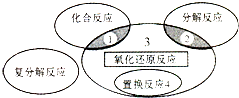
| A. | 4Fe(0H)2+O2+2H2O═4Fe(OH)3 | B. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | ||
| C. | 3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe | D. | Zn+H2SO4═ZnSO4+H2↑ |
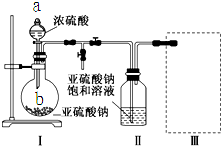 焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验: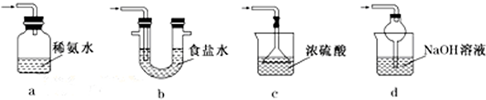

 2C(g)+B(g)△H=+100akJ/mol.
2C(g)+B(g)△H=+100akJ/mol.