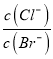��Ŀ����
����Ŀ��������(Si3N4)��һ�������մɲ��ϣ�������ʯӢ�뽹̿�ڸ��µĵ�������ͨ�����·�Ӧ�Ƶã�3SiO2��6C��2N2![]() Si3N4��6CO������˵����ȷ����
Si3N4��6CO������˵����ȷ����
A. �ڵ�����ĺϳɷ�Ӧ�У������ǻ�ԭ��������������������
B. ������Ӧ��ÿ����1 mol�����裬�����õ�12 mol����
C. �÷�Ӧ�����ĸ�������Ӧ����֮һ
D. �÷�Ӧ���ж��������������Ҫβ������װ��
���𰸡�B
��������
A�����ݷ���ʽ��֪��Ӧ�е�Ԫ�صĻ��ϼ۽��ͣ�̼Ԫ�صĻ��ϼ����ߣ���C�ǻ�ԭ����N2����������A����
B����Ӧ�е�Ԫ�ػ��ϼ۴�0�۽��͵���3�ۣ��õ�3�����ӣ���ÿ����1 mol Si3N4��N2�õ�12 mol���ӣ�B��ȷ��
C�����ݷ���ʽ��֪�÷�Ӧ���ǻ��Ϸ�Ӧ���ֽⷴӦ���û���Ӧ���ֽⷴӦ����˸÷�Ӧ�������ĸ�������Ӧ����֮һ��C����
D��CO���ж����壬β����Ҫ������D����
��ѡB��

 ���ĺ����Ͼ�������ϵ�д�
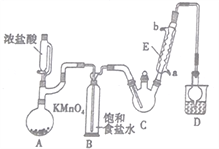
���ĺ����Ͼ�������ϵ�д�����Ŀ��������ȩ�ǻ����л��ϳ�ԭ��֮һ��������ũҩ��ҽҩ����Ҫ�м��塣ij��ѧ��ȤС�������ͼ��ʾװ��(�г֡�����������)��ģ�ҵ���������Ʊ�������ȩ(CCl3CHO)��ʵ�顣
�������ϣ��й���Ϣ���£�
���Ʊ���Ӧԭ����C2H5OH+4Cl2��CCl3CHO+5HCl
���ܷ����ĸ���Ӧ��C2H5OH+HCl��C2H5Cl+H2O��CCl3CHO+HClO��CCl3COOH(��������)+HCl
��������ʵ���Է��������������������ʣ�
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
��Է������� | 46 | 147.5 | 163.5 | 64.5 |
�۵�/�� | -114.1 | -57.5 | 58 | -138.7 |
�е�/�� | 78.3 | 97.8 | 198 | 12.3 |
�ܽ��� | ��ˮ���� | ������ˮ���Ҵ� | ������ˮ���Ҵ���������ȩ | ����ˮ���������Ҵ� |
(1)����E��������____________������ˮ��������________��_______��(�a����b��)��
(2)����������д���һ��ȱ�ݣ���ȱ����__________������ĺ����_________________��
(3)����A�з�����Ӧ�����ӷ���ʽΪ____________________��
(4)��װ��C�ɲ���_______________�����ȵķ����Կ��Ʒ�Ӧ�¶���70�����ҡ�
(5)װ��D����ܵ�����Ϊ_______________��װ��D�ձ��е��Լ���_______________��
(6)��Ӧ������C�еĻ�����з����Cl3CCOOH�ķ�����____________(������)��
(7)��֪��������Ka(CCl3COOH)=1.0��10-1mol��L-1��Ka(CH3COOH)=1.7��10-5mol��L-1�������ʵ��֤���������ᡢ���������ǿ����____________________________��