题目内容
已知:
①向盛有稀H2SO4试管中加入Fe粉,Fe粉完全溶解得浅绿色溶液;
②向实验①浅绿色溶液中滴加NaOH溶液,生成白色沉淀并立即变为红褐色;
③向实验②红褐色沉淀中滴加溶有淀粉的HI溶液,红褐色沉淀溶解得蓝色溶液.
下列判断正确的是( )
①向盛有稀H2SO4试管中加入Fe粉,Fe粉完全溶解得浅绿色溶液;
②向实验①浅绿色溶液中滴加NaOH溶液,生成白色沉淀并立即变为红褐色;
③向实验②红褐色沉淀中滴加溶有淀粉的HI溶液,红褐色沉淀溶解得蓝色溶液.
下列判断正确的是( )
| A、上述实验中,共涉及四个氧化还原反应 | B、实验可证明还原性:H+>Fe2+>OH->I- | C、实验②可证明溶解度:Fe(OH)3>Fe(OH)2 | D、实验③中,反应的离子方程式是:2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O |
分析:①发生Fe+H2SO4═FeSO4+H2↑,②中发生FeSO4+2NaOH═Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O═4Fe(OH)3,③中发生2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O,结合有元素化合价变化的反应为氧化还原反应及氧化还原反应中还原剂的还原性大于还原产物的还原性来解答.
解答:解:①发生Fe+H2SO4═FeSO4+H2↑,
②中发生FeSO4+2NaOH═Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O═4Fe(OH)3,
③中发生2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O,
A.上述实验中,共涉及3个氧化还原反应,FeSO4+2NaOH═Fe(OH)2↓+Na2SO4不属于氧化还原反应,故A错误;
B.由实验③中的反应可知,还原性为I->Fe2+,故B错误;
C.由4Fe(OH)2+O2+2H2O═4Fe(OH)3,溶解度为Fe(OH)3<Fe(OH)2,故C错误;
D.实验③中发生氧化还原反应2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O,遵循电子守恒和电荷守恒、质量守恒定律,故D正确;
故选D.
②中发生FeSO4+2NaOH═Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O═4Fe(OH)3,
③中发生2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O,
A.上述实验中,共涉及3个氧化还原反应,FeSO4+2NaOH═Fe(OH)2↓+Na2SO4不属于氧化还原反应,故A错误;
B.由实验③中的反应可知,还原性为I->Fe2+,故B错误;
C.由4Fe(OH)2+O2+2H2O═4Fe(OH)3,溶解度为Fe(OH)3<Fe(OH)2,故C错误;
D.实验③中发生氧化还原反应2Fe(OH)3+2I-+6H+=2Fe2++I2+6H2O,遵循电子守恒和电荷守恒、质量守恒定律,故D正确;
故选D.
点评:本题考查氧化还原反应,明确发生的化学反应是解答本题的关键,熟悉氧化还原反应中的概念及规律即可解答,题目难度不大.

练习册系列答案
相关题目

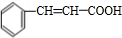 +H2O
+H2O