题目内容
下列有关阿伏加德罗常数NA的说法中,正确的是
[ ]
A.7.1g氯气变为氯离子时,失去的电子数为0.2NA
B.2.0g重水(D2O)所含的电子数为0.1NA
C.28g氮气或28g一氧化碳所含的原子数都是2NA
D.2.3g金属钠变为钠离子时失去0.1NA个电子
答案:CD
解析:
解析:
|
7.1g Cl2变Cl-应得0.2NA电子;因D2O的摩尔质量为20g·mol-1,故2.0g D2O的物质的量为0.1mol,所含电子数应为0.1mol×10=1mol;28g N2、28g CO均为双原子分子,且摩尔质量均为28g·mol-1,故其物质的量均为1mol,原子数均为2NA;2.3g Na物质的量为0.1mol故只能失去0.1NA个电子.故A,B错,C,D正确.本题由于审题不细心或知识掌握不准而错选A,B或漏选. |

练习册系列答案
相关题目
 为阿伏加德罗常数值,下列有关
为阿伏加德罗常数值,下列有关 硫酸钾溶液的说法中错误的是
硫酸钾溶液的说法中错误的是
 总数为0.9
总数为0.9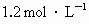
 为阿伏加德罗常数值,下列有关
为阿伏加德罗常数值,下列有关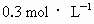 硫酸钾溶液的说法中错误的是
硫酸钾溶液的说法中错误的是
 总数为0.9
总数为0.9



