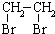题目内容
6.(1)用98%的浓硫酸(密度为1.84g/cm3)配制1mol/L的稀H2SO4100mL.配制过程中可能用到下列仪器:①100mL量筒②10mL量筒③50mL烧杯④托盘天平⑤100mL容量瓶⑥胶体滴管⑦玻璃棒.按使用先后顺序排列正确的是( )A.④③⑦⑤⑥B.②⑤⑦④⑥C.④③⑤⑥⑦D.②③⑦⑤⑥
(2)在配制一定物质的量浓度溶液时,下列操作使得到的溶液浓度偏高、偏低,还是不变?
a.用量筒量取液态溶质,读数时仰视量筒刻度,所配制溶液的浓度偏高
b.将取样品的药匙用水洗涤,洗涤液倒入容量瓶,所配溶液的浓度偏高
c.定容摇匀后,有少量溶液外流,所配制溶液的浓度不变
d.砝码上沾有杂质偏高.
e.容量瓶用蒸馏水洗净后,再用待配溶液润洗偏高.
分析 (1)先根据稀释前后溶质的物质的量不变,计算出浓溶液的体积,选取合适的量筒,再根据配制一定物质的量浓度的溶液需要量取、溶解、移液、洗涤、定容、摇匀等操作解;
(2)分析不当操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)98%的浓硫酸(密度为1.84g/cm3)的物质的量浓度为:C=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,配制1mol/L的稀H2SO4100mL,设需要浓硫酸体积为V,根据稀释前后溶质的物质的量不变得V×18.4mol/L=1mol/L×100ml,解得V=5.4ml,所以应则10ml量筒,实验时用10ml量筒量取5.4ml浓硫酸,而配制一定物质的量浓度的溶液需要量取、稀释、转移、洗涤、定容、摇匀等操作,量取浓硫酸时需要用到10mL量筒和胶头滴管,稀释浓硫酸时需要用到烧杯和玻璃棒,转移溶液时需要用到玻璃棒,定容时需要用到100mL容量瓶和胶头滴管,所以正确顺序为②③⑦⑤⑥;
故选:D;
(2)a.用量筒量取液态溶质,读数时仰视量筒刻度,导致量取的浓硫酸的体积偏大,硫酸的物质的量偏大,溶液的浓度偏高;
故答案为:偏高;
b.将取样品的药匙用水洗涤,洗涤液倒入容量瓶,导致溶质的物质的量偏大,溶液的浓度偏高;
故答案为:偏高;
c.定容摇匀后,有少量溶液外流,依据溶液的均一性可知,溶液的浓度不受影响,
故答案为:不变;
d.砝码上沾有杂质,导致称取的溶质的质量偏大,溶质的物质的量偏大,溶液的浓度偏高;
故答案为:偏高;
e.容量瓶用蒸馏水洗净后,再用待配溶液润洗,导致溶质的物质的量偏大,溶液的浓度偏高;
故答案为:偏高.
点评 本题主要考查了配制一定物质的量浓度溶液的操作步骤和使用仪器依据误差分析,熟悉配制过程是解题关键,题目难度不大.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案| A. | $\frac{a}{b}$ | B. | $\frac{a}{a+b}$ | C. | $\frac{a}{a+2b}$ | D. | $\frac{a}{2a+b}$ |
| A. | n+11 | B. | n+1 | C. | n+3 | D. | n+4 |
| A. | HCl的电子式H:Cl | B. | HClO的结构式H-Cl-O | ||
| C. | Cl-的结构示意图 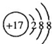 | D. | 质量数为37的氯原子${\;}_{17}^{37}Cl$ |
①漆酚
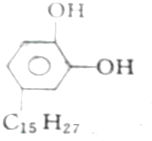
②丁香油酚
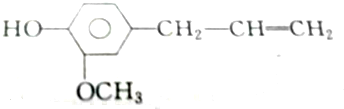
③白藜芦醇
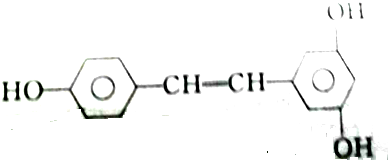
| A. | 2mol、2mol、6mol | B. | 5mol、2mol、6mol | C. | 4mol、2mol、5mol | D. | 3mol、2mol、6mol |
| A. | C5H12的同分异构体数目与甲苯( 一氯代物的数目相同 一氯代物的数目相同 | |
| B. | CH2═CH2+H20 $\stackrel{一定条件}{→}$CH3CH2OH 属于还原反应 | |
| C. | C3H6Cl2有4种同分异构体(不考虑立体异构) | |
| D. | 石油分馏和煤的干馏均属于物理变化. |
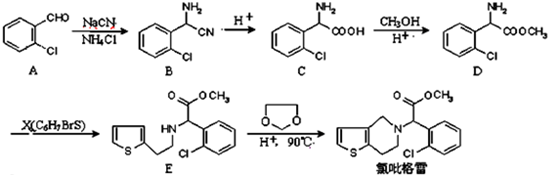
 .
. .
.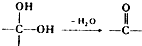 ②
② 中氯原子较难水解物质A(
中氯原子较难水解物质A(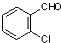 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式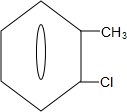 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$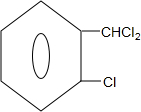 +2HCl;
+2HCl;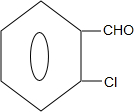 +2NaCl+2H2O
+2NaCl+2H2O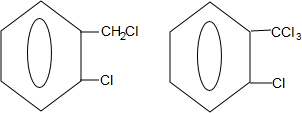
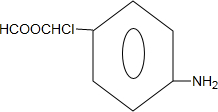
 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$