��Ŀ����
����Ŀ����V��W��X��Y��Z����Ԫ�أ����ǵ�ԭ���������������Ҷ�С��20;����X��Z�ǽ���Ԫ�ء���֪V��Z��ͬһ�壬����ԭ��������Ӳ���ֻ��1������,W��YҲ��ͬһ�壬Wԭ��������Ӳ��ϵ������Ǵ�����Ӳ��ϵ�������3��,Xԭ��������Ӳ��ϵ���������Yԭ��������Ӳ��ϵ�������һ�롣������ص�Ԫ�ط��Żش�
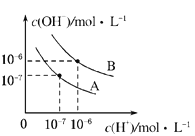
��1��X��Z���Ե�����������Ӧ��ˮ������Է�Ӧ���κ�ˮ���÷�Ӧ�����ӷ���ʽΪ_____________��
��2��X����������Ӧ��ˮ������ˮ�е��뷽��ʽΪ��____________________________________��
��3��W��Z ���γɻ�����Z2W2���û�����ĵ���ʽΪ ______________________________________��
��4��Y��Z�γɵĻ�����ˮ��ҺpH ______ 7����������������������������ӷ���ʽ��ʾ��ԭ�� ____________________________________________________________��
��5����״���£�Y�����������Ϊ��ɫ���壬��������0.20 mol��������һ����Һ̬ˮ��ϵõ�һ��ϡ��Һ�����ų�Q kJ��������д���÷�Ӧ���Ȼ�ѧ����ʽ��________________________________��
��6��W��V ���γɻ�����V2W2���û�����ĽṹʽΪ ______________________________________��
���𰸡� �������1��Al(OH)3��OH-��AlO2-��2H2O �������2��H+��AlO2-��H2O![]() Al(OH)3
Al(OH)3![]() Al3+��3OH- �������3��
Al3+��3OH- �������3�� �������4���� �������5��S2-��H2O
�������4���� �������5��S2-��H2O![]() HS-��OH- HS--��H2O
HS-��OH- HS--��H2O![]() H2S��OH- �������6��SO3(s)��H2O(l)��H2SO4(aq) ��H����5Q kJ��mol-1 �������7��H��O��O�� H
H2S��OH- �������6��SO3(s)��H2O(l)��H2SO4(aq) ��H����5Q kJ��mol-1 �������7��H��O��O�� H
�����������⿼��Ԫ���ƶϣ�V��Z����ͬ����Ԫ�أ������������Ӳ���ֻ��1�����ӣ���Ϊλ��IA�壬ֻ��X��Z�ǽ���Ԫ�أ����VΪH��Wԭ�������������Ǵ�����ϵ�������3�������Wλ�ڵڶ����ڣ���ΪO��W��Y����ͬ���壬��YΪS��Xԭ��������ϵ���������Yԭ��������Ӳ��ϵ�������һ�룬��Ϊԭ����������������XΪAl����ZΪK����1������Ԫ������������Ӧˮ�������ʽΪAl(OH)3��KOH�����������������ԣ�������ӷ�Ӧ����ʽΪAl(OH)3��OH��=AlO2����2H2O����2������������Ӧˮ������Al(OH)3���������ԣ���������ֵ��뷽ʽ������ʽ����ͼ�ʽ���룬H����AlO2����H2O![]() Al(OH)3
Al(OH)3 ![]() Al3����3OH�� ����3���γɵĻ�ѧʽΪK2O2���������ӻ����������Na2O2�ĵ���ʽ����K2O2�ĵ���ʽΪ
Al3����3OH�� ����3���γɵĻ�ѧʽΪK2O2���������ӻ����������Na2O2�ĵ���ʽ����K2O2�ĵ���ʽΪ ����4���γɵĻ�������K2S������ǿ�������Σ�S2������ˮ�⣬S2����H2O
����4���γɵĻ�������K2S������ǿ�������Σ�S2������ˮ�⣬S2����H2O![]() HS����OH������Һ�Լ��ԣ���pH>7����5��Y����������SO3����ˮ��Ӧ����H2SO4����Ӧ����ʽΪSO3��H2O=H2SO4�����1molSO3��Ӧ�ų���������Q/0.2kJ=5QkJ���Ȼ�ѧ��Ӧ����ʽΪ��SO3(s)��H2O(l)��H2SO4(aq) ��H����5Q kJ��mol-1����6���γɵĻ�������H2O2����ṹʽΪH��O��O��H��
HS����OH������Һ�Լ��ԣ���pH>7����5��Y����������SO3����ˮ��Ӧ����H2SO4����Ӧ����ʽΪSO3��H2O=H2SO4�����1molSO3��Ӧ�ų���������Q/0.2kJ=5QkJ���Ȼ�ѧ��Ӧ����ʽΪ��SO3(s)��H2O(l)��H2SO4(aq) ��H����5Q kJ��mol-1����6���γɵĻ�������H2O2����ṹʽΪH��O��O��H��

 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�����Ŀ���ϳɰ������Ĵ����������˹��̵�����Ҫ;�������о�������ȷ������ָ�����ϳɰ���Ӧ��ƽ�ⳣ��Kֵ���¶ȵĹ�ϵ�����
�� �ȣ��棩 | 360 | 440 | 520 |
Kֵ | 0.036 | 0.010 | 0.0038 |
��1�������ϱ����ݿ�֪�÷�ӦΪ_____ ������ȣ����ȣ���ȷ��������Ӧ��
�����д�ʩ������������ԭ��������_____������ţ���
a������ѹǿ�����ںϳɰ� b��ʹ�ú��ʵĴ��������ڿ������ɰ�
c����������Ҫ�����¶���500��C���� d����Ҫʹ�ù�����N2�����H2ת����
��2��0.2mol��������ˮ�����뺬��0.2mol�������Һ��Ӧ����QkJ���������Ȼ�ѧ����ʽ��ʾ�䷴Ӧʽ_____��
��3������ʱ����amol��������ˮ����ͨ��bmol�Ȼ��⣬��Һ���Ϊ1L����c��NH4+��=c��Cl��������һˮ�ϰ��ĵ���ƽ�ⳣ��Kb=_____����ab��ʾ����
��4��ԭ����H2��ͨ����Ӧ CH4��g��+H2O ��g��![]() CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�
CO��g��+3H2��g�� ��ȡ����֪�÷�Ӧ�У�����ʼ������е�![]() �㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
�㶨ʱ���¶ȡ�ѹǿ��ƽ������CH4������Ӱ����ͼ��ʾ��
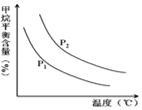
��ͼ�У��������߱�ʾѹǿ�Ĺ�ϵ�ǣ�P1_____P2�����������=����������
����������һ���������¶ȣ������IJ��ʻ�__�����������С����С�������䡱���䣩��
��5��ԭ����H2����ͨ����ӦCO��g��+H2O��g��![]() CO2��g��+H2��g����ȡ��
CO2��g��+H2��g����ȡ��
��T��ʱ�����ݻ��̶�Ϊ5L�������г���1molˮ������1mol CO����Ӧ��ƽ����CO��Ũ��Ϊ0.08molL��1�����¶��·�Ӧ��ƽ�ⳣ��KֵΪ_____��
�ڱ����¶���ΪT�����ݻ����Ϊ5L���ı�ˮ������CO�ij�ʼ���ʵ���֮�ȣ������������з�Ӧ�����������ܹ�˵����ϵ����ƽ��״̬����_____������ţ���
a��������ѹǿ����ʱ��ı�
b�����������ܶȲ���ʱ��ı�
c����λʱ��������a mol CO2��ͬʱ����a mol H2
d���������n��CO����n��H2O����n��CO2����n��H2��=1��16��6��6