题目内容
根据下列实验操作和现象,结论正确的是( )
| 操作 | 实验现象 | 结论 | |
| A | 向某溶液中加入氯化钡、稀硝酸的混合液 | 产生白色沉淀 | 该溶液中一定含有SO42-或SO32- |
| B | 将某气体通入品红溶液 | 溶液红色褪去 | 该气体一定SO2 |
| C | 把湿润的碘化钾--淀粉试纸放入某一红棕色的气体中 | 试纸变蓝色 | 该气体可能是NO2 |
| D | 将通入SO2到酸性高锰酸钾溶液中 | 溶液紫色褪去 | SO2具有漂白性 |
| A、A | B、B | C、C | D、D |
考点:常见气体的检验,常见阴离子的检验
专题:
分析:A.原溶液中可能含有银离子,不等于含有硫酸根离子和亚硫酸根离子;
B.能使品红溶液褪色的气体有氯气、二氧化硫、臭氧等;
C.使湿润的碘化钾-淀粉试纸变蓝色的红棕色的气体可能是NO2;
D.SO2使酸性高锰酸钾溶液褪色是因为其有还原性,而不是漂白性.
B.能使品红溶液褪色的气体有氯气、二氧化硫、臭氧等;
C.使湿润的碘化钾-淀粉试纸变蓝色的红棕色的气体可能是NO2;
D.SO2使酸性高锰酸钾溶液褪色是因为其有还原性,而不是漂白性.
解答:
解:A.生成的白色沉淀可能为AgCl,原溶液中可能含有Ag+,不一定含有SO42-、SO32-,故A错误;
B.二氧化硫能够漂白品红溶液,但是品红溶液褪色的气体不一定为二氧化硫,可能为氯气、臭氧等,故B错误;
C.二氧化氮气体在溶液中能够氧化碘离子,所以该红棕色气体可能为二氧化氮,故C正确;
D.二氧化硫具有还原性,SO2使酸性高锰酸钾溶液褪色是因为二者发生了氧化还原反应,而不是二氧化硫的漂白性,故D错误;
故选C.
B.二氧化硫能够漂白品红溶液,但是品红溶液褪色的气体不一定为二氧化硫,可能为氯气、臭氧等,故B错误;
C.二氧化氮气体在溶液中能够氧化碘离子,所以该红棕色气体可能为二氧化氮,故C正确;
D.二氧化硫具有还原性,SO2使酸性高锰酸钾溶液褪色是因为二者发生了氧化还原反应,而不是二氧化硫的漂白性,故D错误;
故选C.
点评:本题考查了常见气体、离子的检验方法,题目难度中等,注意掌握常见气体、离子的性质及检验方法,明确具有离子存在时,确保检验方案的严密性,排除干扰离子,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
下列说法不正确的是( )
A、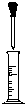 用量筒量取一定量液体时,先从试剂瓶中直接倒入大部分试剂于量筒中,至接近刻度时改用如图所示操作,逐滴加入至刻度 |
| B、金属镁因保存不当造成失火可用细沙盖灭,不能用泡沫灭火器 |
| C、探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 |
| D、可用热氢氧化钠溶液鉴别地沟油(餐饮废弃油)和矿物油(汽油、煤油等) |
下列有关实验正确的是( )
A、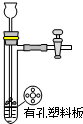 装置用于Na2SO3和浓H2SO4反应制取少量的SO2气体 |
B、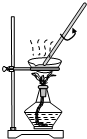 装置用于灼烧CuSO4?5H2O |
C、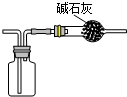 装置用于收集氯气并防止污染空气 |
D、 装置用于实验室制备少量乙酸乙酯 |
下列说法正确的是( )
| A、可用饱和溴水除去苯中的苯酚 |
| B、丙烯加聚时可形成顺反两种聚合物 |
| C、常压下的沸点:1-丙醇>乙醇>丙烷 |
| D、蔗糖及其水解产物均能发生银镜反应 |
下列有关说法中,正确的是( )
| A、苯和乙烯都可以使得溴的四氯化碳溶液褪色 |
| B、等物质的量的乙烯和乙醇完全燃烧消耗氧气的量不相等 |
| C、乙醇的酯化反应和酯的水解反应均属于取代反应 |
| D、聚乙烯可以发生加成反应 |
下列说法错误的是( )
| A、氧化钙用作儿童食品的干燥剂存在安全隐患 |
| B、聚乙烯、聚氯乙烯、聚苯乙烯都是通过加聚反应制得的 |
| C、雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同 |
| D、绿色化学的核心是利用化学原理对环境污染进行治理 |
用铂作电极电解1000mL 0.1mol/L AgNO3溶液,通电一段时间后关闭电源,测得溶液的质量减少了13.4g.下列有关叙述正确的是(NA代表阿伏加德罗常数的值)( )
| A、电解过程中流经外电路的电子数目为0.1NA |
| B、在标准状况下,两极共产生3.92L气体 |
| C、电解后溶液的pH为2(假设溶液体积不变) |
| D、加入13.8g Ag2CO3可将溶液彻底复原 |
工业上制备重要化工原料CH3OH的反应之一为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0.为了探究其反应原理,现进行如下实验,在2L恒容密闭容器内250℃条件下,测得n(CO2)随时间变化情况如表:
下列叙述正确的是( )
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.30 | 0.30 | 0.30 |
| A、v(H2)=3v(CO2)、v逆(CO2)=v正(CH3OH) |
| B、升高温度或减小压强均可使平衡常数增大 |
| C、0~3s内用H2表示的平均反应速率是0.05mol?L-1?s-1 |
| D、增大CO2浓度或选择适当的催化剂均能使该反应的反应速率增大,且平衡向正反应方向移动 |
