题目内容
11.下列说法中正确的是( )| A. | 标准状况下,22.4L水中所含的分子数约为6.02×1023个 | |
| B. | 1 mol Cl2参加反应转移电子数一定为2 NA个 | |
| C. | 48gO3与O2的混合气体中含有的氧原子数为3NA 个 | |
| D. | 从1L0.5 mol/LNaCl溶液中取出100mL,剩余溶液中NaCl物质的量浓度为0.45mol/L |
分析 A、标况下,水为液态;
B、根据反应后氯元素的化合价可能为-1、+1、+3、+5、+7来分析;
C、氧气和臭氧中均由氧原子构成;
D、溶液是均一、稳定的.
解答 解:A、标况下,水为液态,不能根据气体摩尔体积来计算其物质的量,故A错误;
B、反应后氯元素的化合价可能为-1、+1、+3、+5、+7,还可能发生歧化反应,故1mol氯气转移的电子数不一定为2NA个,故B错误;
C、氧气和臭氧中均由氧原子构成,故48g混合物中含有的氧原子的物质的量n=$\frac{48g}{16g/mol}$=3mol,即3NA个,故C正确;
D、溶液是均一、稳定的,与所取的溶液的体积无关,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
2. 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
 普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关系普伐他汀的性质描述正确的是( )| A. | 能与FeCl3溶液发生显色反应 | |
| B. | 1mol该物质与1molBr2发生加成反应,产物有2种 | |
| C. | 能发生加成、取代、消去反应 | |
| D. | 1mol该物质最多可与1molNaOH反应 |
19.在化学反应 A(g)+3B(g)?2C (g)+D(g)中,A、B、C、D的平均反应速率分别为v1、v2、v3、v4,则下列关系正确的是( )
| A. | v1=v2 | B. | v1=2v3 | C. | v3=3v2 | D. | v1=v4 |
6.下列说法正确的是( )
| A. | 活化分子间发生的碰撞就是有效碰撞 | |
| B. | 增大反应物浓度会加快反应速率,原因是增大了活化分子百分数,从而使有效碰撞次数增加 | |
| C. | 吸热反应,升高温度,v正增大,v逆减小 | |
| D. | 有气体参与的反应达到平衡后,增大压强,平衡可能不移动 |
7.连二亚硫酸钠(Na2S2O4),是印刷工业中重要的还原剂.某小组进行如下实验:
Ⅰ.【查阅资料】
(1)连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
(2)2Na2S2O4+4HCl=4NaCl+S↓+3SO2↑+2H2O;Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O.
Ⅱ.【制备方法】
75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:
HCOONa+1Na2CO3+4SO2□=2Na2S2O4+3CO2+□
冷却至40~50℃,过滤,用乙醇洗涤,干燥制得Na2S2O4.
Ⅲ.【Na2S2O4的性质】
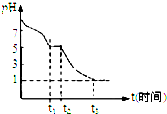
(1)Na2S2O4溶液在空气中易被氧化.课题小组测定0.050mol/LNa2S2O4溶液在空气中pH变化如图所示:0~t1段主要先生成HSO3-,0~t1段发生反应的离子反应方程式为2S2O42-+O2+2H2O=4HSO3-.
t3时溶液中主要阴离子是SO42-.
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体为SO2(填化学式).
请你设计实验验证产物有Na2S2O3存在,完成下表中内容.
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
(3)资料显示:保险粉、H2O2均可用于纸浆漂白.写出保险粉与过量的H2O2,在水溶液中反应生成硫酸盐等物质的离子方程式:S2O42-+3H2O2=2SO42-+2H++2H2O_.
Ⅰ.【查阅资料】
(1)连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇.
(2)2Na2S2O4+4HCl=4NaCl+S↓+3SO2↑+2H2O;Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O.
Ⅱ.【制备方法】
75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:
HCOONa+1Na2CO3+4SO2□=2Na2S2O4+3CO2+□
冷却至40~50℃,过滤,用乙醇洗涤,干燥制得Na2S2O4.
Ⅲ.【Na2S2O4的性质】

(1)Na2S2O4溶液在空气中易被氧化.课题小组测定0.050mol/LNa2S2O4溶液在空气中pH变化如图所示:0~t1段主要先生成HSO3-,0~t1段发生反应的离子反应方程式为2S2O42-+O2+2H2O=4HSO3-.
t3时溶液中主要阴离子是SO42-.
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体为SO2(填化学式).
请你设计实验验证产物有Na2S2O3存在,完成下表中内容.
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取少量完全分解的固体产物于试管中,加入稀盐酸 | 若有淡黄色沉淀,则有Na2S2O3存在 |
4.下列关于影响化学反应速率因素的解释不正确的是( )
| A. | 若仅加入催化剂,改变反应途径→降低反应所需要的活化能→活化分子数增多→有效碰撞次数增多→化学反应速率增大 | |
| B. | 若仅增大反应物浓度,单位体积活化分子数增多→单位体积有效碰撞次数增多→化学反应速率增大 | |
| C. | 若仅升高温度,活化分子百分数增加且分子间的碰撞频率提高→有效碰撞次数增多→化学反应速率增大 | |
| D. | 若仅加大体系压强,体积变小→活化分子百分数增加→单位体积的活化分子数目增加→有效碰撞次数增多→化学反应速率增大 |
5.在一定条件下,pH相同的硫酸和硫酸铁溶液中水电离出来的c(H+)分别是1.0×10-amol.L-1 和1.0×10-bmol.L-1,在此温度下,下列说法正确的( )
| A. | a<b | B. | a=b | ||
| C. | 水的离子积为1.0×10-(7+a) | D. | 水的离子积为1.0×10-(b+a) |
 (2)氮原子
(2)氮原子 (3)Na2S
(3)Na2S (4)H2O
(4)H2O .
.