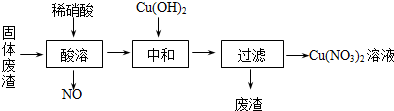
题目内容
7.下列各组顺序的排列正确的是( )| A. | 最高正化合价:F>O>N>C | B. | 离子半径:F->O2->Na+>Al3+ | ||
| C. | 热稳定性:PH3<H2S<HCl<HF | D. | 单质的还原性:Al>Mg>Na>K |
分析 A.O、F元素非金属性很强,F没有正化合价,O无最高正价;
B.电子层结构相同的离子,离子半径随着原子序数增大而减小;
C.元素非金属性越强,其氢化物的稳定性越强;
D.元素的金属性越强,对应的单质的还原性越强.
解答 解:A.O、F元素非金属性很强,F没有正化合价,O无最高正价,故A错误;
B.电子层结构相同的离子,离子半径随着原子序数增大而减小,则:O2->F->Na+>Al3+,故B错误;
C.元素非金属性越强,其氢化物的稳定性越强,非金属性F>Cl>S>P,则热稳定性:PH3<H2S<HCl<HF,故C正确;
D.金属性:K>Na>Mg>Al,元素的金属性越强,对应的单质的还原性越强,则还原性:K>Na>Mg>Al,故D错误;
故选C.
点评 本题考查元素周期律,为高频考点,明确同一周期、同一主族元素原子结构、元素性质关系是解本题关键,知道非金属性、金属性强弱判断方法,注意规律中的反常现象,易错选项是A.

练习册系列答案
相关题目
18.莽草酸结构简式如图.下列说法错误的是( )


| A. | 该物质分子式为C7H10O5 | |
| B. | 该物质与乙酸互为同系物 | |
| C. | 该物质能与乙醇发生酯化反应 | |
| D. | 1 mol该物质与Na反应时,最多消耗Na 4 mol |
15. 如图所示是锌、铜和稀硫酸形成的原电池,某同学做完实验后,在读书卡片上记录如下:
如图所示是锌、铜和稀硫酸形成的原电池,某同学做完实验后,在读书卡片上记录如下:
卡片:No.28 时间:2016.06.10 实验后的记录:
①Zn为正极,Cu为负极
②H+向负极移动
③电子流动方向为Zn→Cu
④Cu极有H2产生
⑤若有1mol电子流过导线,则产生的H2为0.5mol
⑥正极反应为Zn-2e-═Zn2+
卡片上的描述合理的是( )
 如图所示是锌、铜和稀硫酸形成的原电池,某同学做完实验后,在读书卡片上记录如下:
如图所示是锌、铜和稀硫酸形成的原电池,某同学做完实验后,在读书卡片上记录如下:卡片:No.28 时间:2016.06.10 实验后的记录:
①Zn为正极,Cu为负极
②H+向负极移动
③电子流动方向为Zn→Cu
④Cu极有H2产生
⑤若有1mol电子流过导线,则产生的H2为0.5mol
⑥正极反应为Zn-2e-═Zn2+
卡片上的描述合理的是( )
| A. | ③④⑤ | B. | ①②③ | C. | ①⑤⑥ | D. | ②③④ |
12.下列与有机物的结构、性质有关的说法正确的是( )
| A. | C5H12属于烷烃且有2种同分异构体 | |
| B. | 乙烯、氯乙烯、甲苯分子中的所有原子均共平面 | |
| C. | C4H10与Cl2在光照条件下反应,可生成4种一氯代烃 | |
| D. | 苯分子中不含碳碳双键,所以不能发生加成反应 |
17.设NA 表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 3g甲醛所含碳原子数为0.2NA | |
| B. | 1mol CH3OH分子含有的电子总数为18NA | |
| C. | 44gC3H8中含有共价键的数目为11NA | |
| D. | 17g羟基中含有的电子数为10NA |
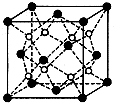 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子各内层均排满,且最外层有成单电子;D与E同周期,价电子数为2.则: