题目内容
下列实验方法或数据合理的是
- A.用托盘天平准确称取9.8g NaCl 固体
- B.用25mL碱式滴定管准确量取22.00 mL的KMnO4溶液
- C.用广泛pH试纸测出某盐酸溶液的pH为3.2
- D.用10mL量筒量取7.50mL稀盐酸
分析:A.托盘天平称量物质准确度为0.1g;
B.高锰酸钾能腐蚀橡胶;
C.广泛pH试纸测定的pH值为整数;
D.量筒量取液体体积的准确度为0.1mL.
解答:A.托盘天平称量物质准确度为0.1g,可称取9.8g食盐,故A正确;
B.量取高锰酸钾溶液应用酸式滴定管,故B错误;
C.广泛pH试纸测定的pH值为整数,3.2是小数,所以不合理,故C错误;
D.量筒量取液体体积的准确度为0.1mL,所以量取7.50mLmL不合理,故D错误.
故选A.
点评:本题考查对一些测量仪器的准确度及仪器规格的掌握情况,难度较大,同时考查思维的准确性、严密性,解此题的关键在于要依据所用仪器的准确度.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案(11 分)科学家一直致力研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3,反应的化学方程式如下:N2(g)+ 3H2O(l) 2NH3(g)+ O2(g)。回答下列问题:
(1)进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105Pa、反应时间3 h),则该反应的正反应为 反应(填“吸热”或“放热”)
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(3)合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数
据如下:
H2(g) :△H=-285.8 kJ・mol-1;
CO(g) :△H =-283.0 kJ・mol-1;
CH4(g) :△H=-890.3 kJ・mol-1 。
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式__________________________________。
(4)有人设想寻求适合的催化剂和电极材料,以N2、H2为电极反应物,以HCl——NH4Cl为电解质溶液制成新型燃料电池,请写出该电极的正极反应式
(5)生成的NH3可用于制铵态氮肥,如(NH4)2SO4、NH4Cl,这些肥料显 性,原因是(用离子方程式表示)___________________________,使用时避免与________________物质合施。
(11 分)科学家一直致力研究常温、常压下“人工固氮”的新方法。曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3,反应的化学方程式如下:N2(g)+ 3H2O(l)  2NH3(g)+ O2(g)。回答下列问题:
2NH3(g)+ O2(g)。回答下列问题:
(1)进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间3 h),则该反应的正反应为 反应(填“吸热”或“放热”)
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10-6 mol) |
4.8 |
5.9 |
6.0 |
(2)与目前广泛使用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议: 。
(3)合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部分物质的燃烧热数
据如下:
H2(g) :△H =-285.8 kJ・mol-1;
CO(g) : △H =-283.0 kJ・mol-1;
CH4(g) :△H =-890.3 kJ・mol-1 。
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O在高温下反应的热化学方程式__________________________________。
(4)有人设想寻求适合的催化剂和电极材料,以N2、H2为电极反应物,以HCl——NH4Cl为电解质溶液制成新型燃料电池,请写出该电极的正极反应式
(5)生成的NH3可用于制铵态氮肥,如(NH4)2SO4、NH4Cl,这些肥料显 性,原因是(用离子方程式表示)___________________________,使用时避免与________________物质合施。
 NH3H2O+H+
NH3H2O+H+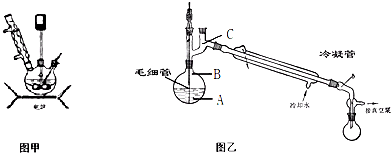
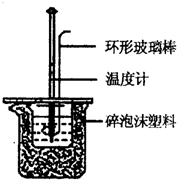 实验室用50mL 0.50mol/L盐酸、50mL 0.55mol/L NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol/L盐酸、50mL 0.55mol/L NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据: