题目内容
53克Na2CO3溶于蒸馏水中配成250mL溶液,所得溶液物质的量浓度是多少.
考点:溶液的配制
专题:计算题
分析:向根据n=
计算出53g碳酸钠的物质的量,再根据c=
计算出配制的碳酸钠溶液的物质的量浓度,据此进行解答.
| m |
| M |
| n |
| V |
解答:
解:53g碳酸钠的物质的量为:n(Na2CO3)=
=0.5mol,
配制的溶液的浓度为:c(Na2CO3)=
=2mol/L,
答:所得碳酸钠溶液的浓度为2mol/L.
| 53g |
| 106g/mol |
配制的溶液的浓度为:c(Na2CO3)=
| 0.5mol |
| 0.25L |
答:所得碳酸钠溶液的浓度为2mol/L.
点评:本题考查了有关物质的量浓度的简单计算,题目难度不大,注意掌握物质的量浓度的概念及计算方法,明确物质的量与摩尔质量、物质的量浓度之间的转化关系为解答本题的关键.

练习册系列答案
相关题目
日常生活和工业生产中常用到漂白剂.下列物质没有漂白作用的是( )
| A、HClO |
| B、SO2 |
| C、新制氯水 |
| D、CaCl2 |
 反应N2O4(g)?2NO2(g)△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )
反应N2O4(g)?2NO2(g)△H=+57kJ?mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是( )| A、A、C两点的反应速率:A>C |
| B、A、C两点气体的颜色:A深,C浅 |
| C、由状态B到状态A,可以用加热的方法 |
| D、A、C两点气体的转化率:A>C |
下列各组物质,即不是同系物,又不是同分异构体的是( )
| A、甲醛和丙醛 |
| B、丙酸和丁酸 |
| C、乙酸和甲酸甲酯 |
| D、甲酸和乙二酸 |

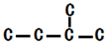 ,此烷烃的一溴代物有
,此烷烃的一溴代物有
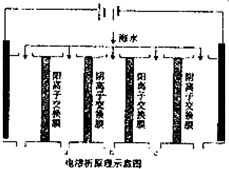 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水的处理主要包括水的净化、污水处理、硬水软化和海水的淡化等.
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水的处理主要包括水的净化、污水处理、硬水软化和海水的淡化等. ,请写出ABS的结构简式
,请写出ABS的结构简式