题目内容
19.将反应Zn+CuSO4═ZnSO4+Cu设计成原电池.下列判断不正确的是( )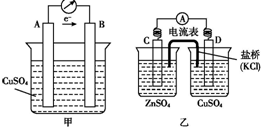
| A. | 若设计成图甲所示的原电池,电极A、B分别是Zn、Cu | |
| B. | 若设计成图乙所示的原电池,D电极反应式为:Cu2++2e-═Cu | |
| C. | 原电池乙工作时,盐桥中的K+移向CuSO4溶液,Cl-移向ZnSO4溶液 | |
| D. | 其他条件相同时,原电池甲比原电池乙的可储存时间长 |
分析 A、甲中,据电子流向确定,A为负极B为正极;
B、乙中,据电解质溶液分析,C为负极Zn,D为正极Cu;
C、原电池的盐桥中,阳离子移向正极,阴离子移向负极;
D、甲中Zn直接与硫酸铜溶液接触,存储时间短.
解答 解:A、Zn比Cu活泼,Zn为负极,Cu为正极,所以电极A、B分别是Zn、Cu,故A正确;
B、乙中,D为正极,铜离子在正极上得电子,电极反应式为Cu2++2e-═Cu,故B正确;
C、C为负极,D为正极,所以盐桥中的K+移向CuSO4溶液,Cl-移向ZnSO4溶液,故C正确;
D、甲中Zn直接与硫酸铜溶液接触,存储时间短,故D错误;
故选D.
点评 本题考查了原电池中电子流向确定正负极以及离子在盐桥中移动、盐桥的作用,题目难度不大.

练习册系列答案
相关题目
10.葡萄糖的分子式为C6H12O6,其中氧的质量分数为是( )
| A. | 33.3% | B. | 25.0% | C. | 50.0% | D. | 53.3% |
4.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列事实不能说明上述观点的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,苯不能使酸性高锰酸钾溶液褪色 | |
| B. | 苯酚能跟NaOH溶液反应,乙醇不能与NaOH溶液反应 | |
| C. | 乙烯能发生加成反应,乙烷不能发生加成反应 | |
| D. | 苯与硝酸在加热时发生取代反应,甲苯与硝酸在常温下就能发生取代反应 |
11.已知 和
和 (A、B为不同的原子或原子团)互为同分异构体,称为烯烃的顺反异构.试推断一氯丙烯的同分异构体(不含环状结构)有( )
(A、B为不同的原子或原子团)互为同分异构体,称为烯烃的顺反异构.试推断一氯丙烯的同分异构体(不含环状结构)有( )
 和
和 (A、B为不同的原子或原子团)互为同分异构体,称为烯烃的顺反异构.试推断一氯丙烯的同分异构体(不含环状结构)有( )
(A、B为不同的原子或原子团)互为同分异构体,称为烯烃的顺反异构.试推断一氯丙烯的同分异构体(不含环状结构)有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
8.下列反应中,Q2>Q1的是( )
| A. | H2(g)+F2(g)=2HF(g)△H=-Q1 kJ•mol-1 H2(g)+Cl2(g)=2HCl(g)△H=-Q2 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)=2H2O(l)△H=-Q1 kJ•mol-1 2H2(g)+O2(g)=2H2O(g)△H=-Q2 kJ•mol-1 | |
| C. | NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-Q1 kJ•mol-1 NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=-Q2 kJ•mol-1 | |
| D. | S(s)+O2(g)=SO2(g)△H=-Q1 kJ•mol-1 S(g)+O2(g)=SO2(g)△H=-Q2 kJ•mol-1 |
9.钠硫电池属于温绿色二次电流,用液态钠、硫和多硫化钠作电极,以能传导钠离子的固体氧化铝作电解质.电池反应为:2Na+xS$?_{充电}^{放电}$Na2Sx.下列有关说法正确的是( )
| A. | 放电时,Na+向负极移动 | |
| B. | 放电时,正极上发生的反应为xS+2Na++2e-=Na2Sx | |
| C. | 充电时,阳极上发生的反应为2Na-2e-=2Na+ | |
| D. | 放电时,每有0.4mol电子转移,则有9.2gNa和6.4g硫参加反应 |

 ,它与H的单质在光照下的第一步反应为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl该反应属于取代反应.
,它与H的单质在光照下的第一步反应为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl该反应属于取代反应.

 .
.