题目内容
20.除去下列物质中的少量杂质(括号内为杂质),所选试剂和分离方法能达到实验目的是( )| 混合物 | 试剂 | 分离方法 | |
| A | 淀粉(氯化钠) | 蒸馏水 | 渗析 |
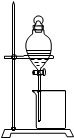
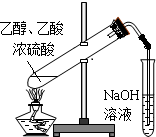
| B | 乙醇(乙酸) | 生石灰 | 分液 |
| C | 苯(苯酚) | 溴水 | 过滤 |
| D | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.胶粒不能透过半透膜,溶液可以透过半透膜;
B.乙酸具有酸性,能和氧化钙反应生成盐和水;
C.溴、三溴苯酚单质易溶于苯;
D.乙酸乙酯能与NaOH反应.
解答 解:A.淀粉是胶体,氯化钠是溶液,胶粒不能透过半透膜,溶液可以透过半透膜,故可用渗析分离,故A正确;
B.乙酸具有酸性,能和氧化钙反应生成盐和水,应用蒸发的方法分离,乙醇易挥发,而乙酸钙难以挥发,可将二者分离,故B错误;
C.除杂所加的试剂是过量的,溴、三溴苯酚易溶于苯,过量的溴无法用过滤分离,引入了新杂质,故C错误;
D.乙酸能与NaOH溶液反应,但乙酸乙酯也能与NaOH反应,故D错误;
故选A.
点评 本题主要主要考查了物质的除杂,难度不大,抓住除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质是解题的关键.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
12.化学在生产生活中有重要作用,下列说法正确的是( )
| A. | 碘有智力元素之称,所以应该大量服用补碘药片 | |
| B. | 汽车尾气中的氮氧化物是汽油不完全燃烧产生的 | |
| C. | 二氧化硫可用于食品防腐,但不能用于食品漂白 | |
| D. | “辽宁舰”上使用的特种钢缆属于新型无机非金属材料 |
11.已知下列反应的反应热:
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ/mol
则2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
①CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ/mol
则2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
| A. | -870.3 kJ/mol | B. | -571.6 kJ/mol | C. | +787.0 kJ/mol | D. | -488.3 kJ/mol |
15.对下列各有机物的叙述,正确的是( )
| A. | 蛋白质有多种生理功能,其水解的最终产物都是a-氨基酸 | |
| B. | 将溴乙烷与NaOH水溶液混合共热后加入足量硝酸酸化,再加入硝酸银溶液后会观察到淡黄色沉淀生成 | |
| C. | 取淀粉与稀硫酸共热后的溶液,加入新制的氢氧化铜悬浊液并加热,没有砖红色沉淀产生,说明淀粉尚未水解成葡萄糖 | |
| D. | 乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 |
12.已知乙炔(C2H2)、苯(C6H6)、苯酚(C6H6O)的混合气体中含氢元素的质量分数为7%,则混合气体中氧元素的质量分数为( )
| A. | 83% | B. | 24% | C. | 68% | D. | 9% |
10.下列反应既属于氧化还原反应,又属于吸热反应的是( )
| A. | 铝片和稀盐酸反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 酒精在氧气中的燃烧 | D. | 灼热的碳与水蒸汽的反应 |
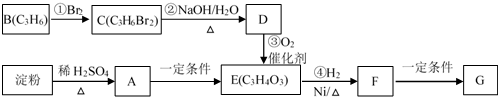
 .
.
 +2H2O.
+2H2O.