题目内容
9.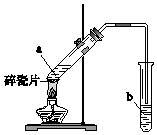 实验室用如图所示装置制备乙酸乙酯.
实验室用如图所示装置制备乙酸乙酯. (1)实验前,向试管a中加入3mL乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL乙酸.
(2)试管a中生成乙酸乙酯的化学方程式是CH3COOH+C2H5OH $?_{△}^{催化剂}$ CH3COOC2H5+H2O.
(3)试管b中盛放的试剂是饱和Na2CO3溶液.试管b中的导管不能伸入液面下的原因是防止b中溶液倒吸入a中.
(4)反应结束后,从试管b中分离出乙酸乙酯的方法是分液.
分析 (1)为防止酸液飞溅,应先加入乙醇,然后在加入浓硫酸和乙酸;
(2)酯化反应的本质为酸脱羟基,醇脱氢,该反应生成乙酸乙酯和水,且为可逆反应;
(3)制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,饱和碳酸钠溶液的主要作用是溶解乙醇,碳酸钠与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;导管不能插入液面下的原因是防止倒吸;
(4)乙酸乙酯不溶于水,混合物分层.
解答 解:(1)浓硫酸溶于水放出大量的热,乙醇中含有少量水,应将浓硫酸加入到乙醇中,防止硫酸溶解时放出大量的热导致液体飞溅,则加入药品的顺序为先在大试管中注入乙醇,再分别缓缓加入浓硫酸和乙酸(乙酸和浓硫酸的加入顺序可互换),边加边振荡试管使之混合均匀,即加入顺序为乙醇、浓硫酸、乙酸,
故答案为:乙醇;浓硫酸;
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应,反应的化学方程式为:CH3COOH+CH3CH2OH$?_{△}^{催化剂}$CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{催化剂}$CH3COOCH2CH3+H2O;
(3)乙酸乙酯不溶于饱和碳酸钠溶液,乙醇易溶于水,乙酸可与碳酸钠发生反应而被吸收,用饱和碳酸钠溶液可将乙酸乙酯和乙醇、乙酸分离,反应的化学方程式为 2CH3COOH+Na2CO3→2CH3COONa+CO2↑+H2O,试管b中盛放的试剂是饱和碳酸钠溶液,挥发出的乙酸、乙醇易溶于水,导气管下端管口不能浸入液面插入溶液中防止倒吸,导管要插在饱和碳酸钠溶液的液面上,伸入液面下会发生倒吸,
故答案为:Na2CO3;防止b中溶液倒吸入a中;
(4)乙酸乙酯不溶于水,则要把制得的乙酸乙酯分离出来,应采用的实验操作是分液,
故答案为:分液.
点评 本题考查乙酸乙酯的制备实验,为基础性习题,把握制备原理、实验装置的作用、混合物分离提纯方法为解答的关键,侧重分析与实验能力的考查,注意有机物的性质及应用,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | $\frac{2(a+b)}{5b}$×100% | B. | $\frac{a+b}{5b}$×100% | C. | $\frac{2(a+b)}{5}$×100% | D. | $\frac{2(a+b)}{5a}$×100% |
| A. | 分子式为C 4H 8的同分异构体共有(不考虑立体异构)5种 | |
| B. | 立方烷(C 8H 8)的六氯取代物有3种 | |
| C. | 分子式为C 5H 10O 2的同分异构体中属于酯的有8种 | |
| D. |  的一溴取代物有4种 的一溴取代物有4种 |

| A. | 常温下,产物中只有一种是气体 | |
| B. | 单质B可能是F2 | |
| C. | 向反应后的混合物中通如NH3,会有白烟产生 | |
| D. | A分子中存在4个非极性键 |
| A. | 2.7g A1与NaOH溶液完全反应,转移的电子数为0.2NA | |
| B. | 常温下,2.24L N2和O2的混合气体分子数为0.1NA | |
| C. | O.1 mol的14C中,含有的电子数为0.8NA | |
| D. | 0.1 mol H2(g)和0.3molCl2(g)于密闭容器中充分反应后,容器中气体分子总数为0.4NA |
 ,能用该结构简式表示的M的同分异构体共有(不考虑立体异构)( )
,能用该结构简式表示的M的同分异构体共有(不考虑立体异构)( )| A. | 12 种 | B. | 16 种 | C. | 20 种 | D. | 24 种 |

 氨在化肥生产、贮氢、燃煤烟气脱硫脱硝等领域用途非常广泛.
氨在化肥生产、贮氢、燃煤烟气脱硫脱硝等领域用途非常广泛. FeCl2是一种常见的还原剂,实验室可以用H2还原无水FeCl3制取(如图).
FeCl2是一种常见的还原剂,实验室可以用H2还原无水FeCl3制取(如图).