题目内容
某硫酸、硫酸亚铁、硫酸铁的混合液100mL中,阳离子浓度均相等,已知SO
答案:
解析:
解析:
| 设:
0.1 mol H2SO4中可溶解Fe粉0.1mol。 0.1 mol Fe2(SO4)3中可溶解Fe粉0.1 mol。 所以共可溶解0.2 mol Fe即为11.2g。
|

练习册系列答案
相关题目
某同学用工业硫酸铜(含硫酸亚铁等杂质)制备纯净的CuSO4?5H2O.
Ⅰ.取工业硫酸铜固体,用稀硫酸溶解,过滤.
Ⅱ.向滤液中滴加H2O2溶液,稍加热.
Ⅲ.向II的溶液中加入Cu2(OH)2CO3粉末至pH为3.9~4.1.
Ⅳ.加热煮沸,过滤,滤液用稀硫酸酸化至pH=1.
Ⅴ.加热浓缩、冷却结晶、过滤,得晶体.
已知部分阳离子生成氢氧化物的pH如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 6.7 |
(2)Ⅱ中将Fe2+氧化为Fe3+的目的是______.
(3)用K3[Fe(CN)6](铁氰化钾)验证Ⅱ中Fe2+是否转化完全的现象是______.
(4)Ⅲ中发生反应的离子方程式是______.
(5)应用化学平衡移动原理解释Ⅳ中“滤液用稀硫酸酸化”的原因______.
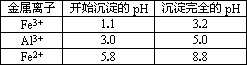
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾通过下列反应制备:FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH.
(1)制备FeCO3时,选用的加料方式是______ (填字母),原因是______.
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是______.
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.①铁粉的作用是______.②反应结束后,无需过滤,除去过量铁粉的方法是______.
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是______.
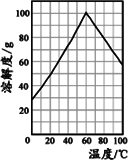
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3) 出发,先制备绿矾,再合成柠檬酸亚铁.请结合如图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4?7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,______,得到FeSO4溶液,______,得到FeSO4?7H2O 晶体.

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是______.
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.①铁粉的作用是______.②反应结束后,无需过滤,除去过量铁粉的方法是______.
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是______.
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3) 出发,先制备绿矾,再合成柠檬酸亚铁.请结合如图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4?7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,______,得到FeSO4溶液,______,得到FeSO4?7H2O 晶体.

 (2013?江苏)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4?7H2O)通过下列反应制备:FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算).
(2013?江苏)柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4?7H2O)通过下列反应制备:FeSO4+Na2CO3═FeCO3↓+Na2SO4 FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol?L-1计算).