题目内容
中学化学中几种常见物质的转化关系如图所示,A是常见金属单质,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体.
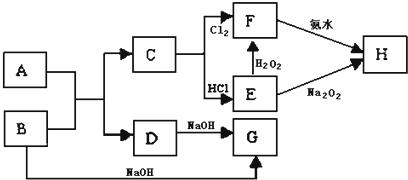
请回答下列问题:
(1)红褐色胶体中H粒子的直径大小范围 ;
(2)写出D的一种工业用途: ;
(3)①写出H2O2的电子式: ;
②写出B→G的化学方程式 ;
③写出F转化为E的离子方程式 .

请回答下列问题:
(1)红褐色胶体中H粒子的直径大小范围
(2)写出D的一种工业用途:
(3)①写出H2O2的电子式:
②写出B→G的化学方程式
③写出F转化为E的离子方程式
考点:无机物的推断,常见金属元素的单质及其化合物的综合应用
专题:推断题,几种重要的金属及其化合物
分析:已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体推断H为Fe(OH)3,C+Cl2→F,判断F为FeCl3,C为Fe,E和过氧化氢反应生成F,说明E为FeCl2,转化关系中的B、D都和氢氧化钠反应,A+B=C+D是金属置换铁的置换反应,判断为A为Fe2O3,B为Al,D为Al2O3,G为NaAlO2,结合对应物质的性质以及题目要求解答该题.
解答:
解:已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体推断H为Fe(OH)3,C+Cl2→F,判断F为FeCl3,C为Fe,E和过氧化氢反应生成F,说明E为FeCl2,转化关系中的B、D都和氢氧化钠反应,A+B=C+D是金属置换铁的置换反应,判断为A为Fe2O3,B为Al,D为Al2O3,G为NaAlO2,
(1)胶体粒子直径介于1~100nm,故答案为:1~100nm;
(2)D为Al2O3,熔点高,可用与耐高温材料,还可用于冶炼铝,故答案为:耐火材料或电解法制金属铝;
(3)①H2O2的电子式为: ,故答案为:
,故答案为: ;
;
②铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
③氯化铁具有强氧化性,可与铁反应生成氯化亚铁,反应的方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+.
(1)胶体粒子直径介于1~100nm,故答案为:1~100nm;
(2)D为Al2O3,熔点高,可用与耐高温材料,还可用于冶炼铝,故答案为:耐火材料或电解法制金属铝;
(3)①H2O2的电子式为:
 ,故答案为:
,故答案为: ;
;②铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
③氯化铁具有强氧化性,可与铁反应生成氯化亚铁,反应的方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+.
点评:本题以元素化合物的推断为载体考查了元素化合物的性质,通过元素化合物的推断考查学生的推理、分析、判断等能力,正确推断元素化合物是解本题的关键,题目难度中等.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
实验中下列操作不正确的是( )
A、蒸馏实验时,蒸馏烧瓶中盛有约
| ||
| B、蒸馏实验时,将温度计的水银球插入液体中 | ||
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | ||
| D、蒸发操作时,应使混合物中剩有少量水份时即停止加热 |
常温下,关于溶液的稀释下列说法正确的是( )
| A、pH=3的醋酸溶液稀释100倍,pH=5 |
| B、pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 mol?L-1 |
| C、将1L 0.1mol?L-1的Ba(OH)2溶液稀释为2L,pH=13 |
| D、pH=8的NaOH溶液稀释100倍,其pH=6 |
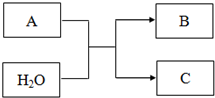 A、B、C均为短周期元素组成的物质,其转化关系如下:
A、B、C均为短周期元素组成的物质,其转化关系如下: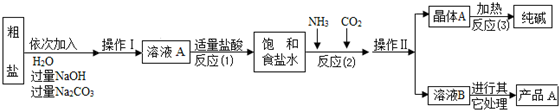

 .
.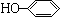 )的电离平衡常数K2的相对大小
)的电离平衡常数K2的相对大小