题目内容
25℃时,将amol/L一元酸HA与bmol/L NaOH等体积混合后测得溶液pH=7,则下列关系一定不正确的( )
| A、a=b | B、a>b | C、c(A-)=c(Na+) | D、c(A-)<c(Na+) |
分析:根据HA是强酸还是弱酸,结合盐类水解判断a、b关系;根据溶液呈电中性可知,溶液中c(A-)+c(OH-)=c(Na+)+c(H+),结合溶液的pH值判断c(A-)、c(Na+)的相对大小.
解答:解:A、若HA为强酸,溶液pH=7,HA与NaOH等体积混合恰好反应,故a=b,若HA为弱酸,生成强碱弱酸盐NaA,溶液会呈碱性;由于溶液pH=7,HA与NaOH等体积混合,HA应过量,故a>b,综上所述,a≥b,故A正确;
B、由A分析可知,应该满足a≥b,故B正确;
C、溶液中c(A-)+c(OH-)=c(Na+)+c(H+),溶液pH=7,则c(OH-)=c(H+),故c(A-)=c(Na+),故C正确;
D、由C中分析可知,溶液中一定满足c(A-)=c(Na+),故D错误;
故选:D.
B、由A分析可知,应该满足a≥b,故B正确;
C、溶液中c(A-)+c(OH-)=c(Na+)+c(H+),溶液pH=7,则c(OH-)=c(H+),故c(A-)=c(Na+),故C正确;
D、由C中分析可知,溶液中一定满足c(A-)=c(Na+),故D错误;
故选:D.
点评:本题考查溶液中离子浓度比较、酸碱反应pH的定性判断、盐类水解等知识,题目难度中等,注意酸HA的强弱讨论方法及电荷守恒、物料守恒在比较离子间关系时的应用.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
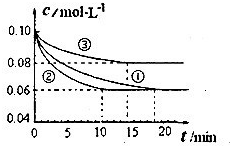 (2013?烟台一模)氮及其化合物在工农业生产中具有重要作用.
(2013?烟台一模)氮及其化合物在工农业生产中具有重要作用. 2NH3(g)
△H<0的模拟研究,在1L密闭容器中,分别加入0.1mol
N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g)
△H<0的模拟研究,在1L密闭容器中,分别加入0.1mol
N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 减小
减小
 2NO2 (g) ΔH<0,
2NO2 (g) ΔH<0,