题目内容
19.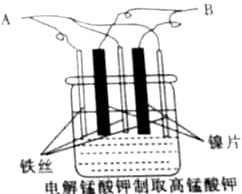 制备KMnO4的最佳方法是电解法,实验室以镍片(不参与反应)和铁丝作电极,电解K2MnO4的水溶液(绿色)制备KMnO4,装置如图:
制备KMnO4的最佳方法是电解法,实验室以镍片(不参与反应)和铁丝作电极,电解K2MnO4的水溶液(绿色)制备KMnO4,装置如图:①A应与直流电源的负极相连接,铁丝电极的电极反应式为2H++2e-=H2↑;
②电解过程中观察到的明显实验现象为阴极上有气泡生成,阳极附近溶液由绿色变为紫色(答两条即可).
③电解的总反应的离子方程式为2MnO42-+2H2O$\frac{\underline{\;电解\;}}{\;}$2MnO4-+2OH-+H2↑.电解一段时间后,溶液的pH变大(“减小”、“变小”或“不变”).
分析 电解总反应为2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+2KOH+H2↑,铁丝作阴极,阴极上氢离子得电子,阴极的电极方程式2H++2e-=H2↑,镍片为阳极,阳极反应为MnO42--e-═MnO4-,据此分析解答.
解答 解:①根据电解总反应为2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+2KOH+H2↑可知,铁没有参与反应,所以铁丝为阴极,则A应与直流电源的负极相连,阴极的电极方程式2H++2e-=H2↑,
故答案为:负;2H++2e-=H2↑;
②电解过程中,阴极上生成氢气,阳极上MnO42-失电子生成MnO4-,则阳极附近溶液由绿色变为紫色;
故答案为:阴极上有气泡生成,阳极附近溶液由绿色变为紫色;
③电解总反应为2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+2KOH+H2↑,其离子方程式为:2MnO42-+2H2O$\frac{\underline{\;电解\;}}{\;}$2MnO4-+2OH-+H2↑,电解时生成氢氧根离子,所以溶液的碱性增强,pH变大;
故答案为:2MnO42-+2H2O$\frac{\underline{\;电解\;}}{\;}$2MnO4-+2OH-+H2↑;变大.
点评 本题主要考查电解池原理的应用,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写,题目难度中等.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
9. 有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
Ⅰ合成:
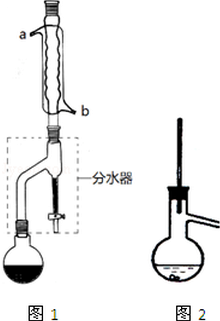
在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mL)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水去回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离提纯:
①将烧瓶中反应后的混合物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10mL水、10mL10%碳酸钠溶液洗至无酸性(pH=7),充分震荡后静置,分去水层.
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品,主要试剂及产物的物理常数如表:
制备过程中还可能与的副反应有2CH3CH2CH2CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
根据以上信息回答下列问题:
(1)合成和分离过程中均使用沸石,其作用防止液体加热时发生暴沸.
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从b(填a或b)管口通入.
(3)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先过滤(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有正丁醚杂质.
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在bd中加热比较合适(请从下列选项中选择).
A.水 B.甘油(沸点290℃) C.沙子 D.石蜡油(沸点200~300℃)
(5)如何根据装置中的实验现象判断该合成反应达到了终点分水器中水面不再升高.
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的利用率约为88%.
 有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mL)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水去回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离提纯:
①将烧瓶中反应后的混合物冷却后与分水器中的酯层合并,转入分液漏斗,依次用10mL水、10mL10%碳酸钠溶液洗至无酸性(pH=7),充分震荡后静置,分去水层.
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品,主要试剂及产物的物理常数如表:
| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
根据以上信息回答下列问题:
(1)合成和分离过程中均使用沸石,其作用防止液体加热时发生暴沸.
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从b(填a或b)管口通入.
(3)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先过滤(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有正丁醚杂质.
(4)步骤③的常压蒸馏,需控制一定的温度,你认为在bd中加热比较合适(请从下列选项中选择).
A.水 B.甘油(沸点290℃) C.沙子 D.石蜡油(沸点200~300℃)
(5)如何根据装置中的实验现象判断该合成反应达到了终点分水器中水面不再升高.
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的利用率约为88%.
10.下列有关实验原理或操作正确的是( )
| A. | 用托盘天平称量8.70g食盐 | |
| B. | 用广泛pH试纸测定氯水的pH值为3.5 | |
| C. | 在蒸发皿中灼烧氢氧化铁获得铁红 | |
| D. | 用加热的方法分离氯化钠和氯化铵的固体混合物 |
7.核中中子数为N的R2-,质量数为A,则该离子的核外电子数为( )
| A. | A-N-2 | B. | A-N+2 | C. | A+N-2 | D. | A+N+2 |
4.下列有关叙述正确的是( )
| A. | 皂化反应是指酯在碱性条件下的水解过程 | |
| B. | 硬水使肥皂的去污能力减弱是因为发生了沉淀反应 | |
| C. | 判断油脂皂化反应是否基本完成,可通过反应后的溶液能否使红色石蕊试纸变蓝色 | |
| D. | 使高级脂肪酸从皂化反应后的混合物中析出,可用氧化钠固体 |
11.三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是( )
| A. | 原子数目相等的三种气体,质量最大的是Z | |
| B. | 相同条件下,同质量的三种气体,气体密度最小的是X | |
| C. | 若一定条件下,三种气体体积均为2.24L,则它们的物质的量一定均为0.1mol | |
| D. | 同温下,体积相同的两容器分别充2gY气体和1gZ气体,则其压强比为2:1 |
16.下列物质既能使酸性高锰酸钾溶液褪色,又能使溴水褪色的是( )
| A. | 乙酸乙酯 | B. | 汽油 | C. | 乙酸 | D. | 植物油 |
17.下列有关有机物的实验操作、现象或结论不正确的是( )
| A. | 提纯含有杂质的工业乙醇,常用的方法是蒸馏 | |
| B. | 常温下,将二氧化碳通入苯酚钠溶液,溶液会变浑浊 | |
| C. | 混有泥沙的苯甲酸,除去杂质的方法是将其溶解后过滤,再蒸发结晶即可 | |
| D. | 苯和苯酚稀溶液分别与浓溴水混合,后者产生白色沉淀 |