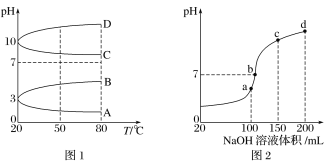
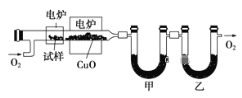
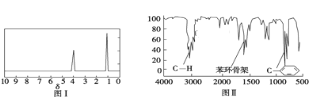
题目内容
【题目】某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍; W、X、Y三种简单离子的核外电子排布相同。下列说法不正确的是:
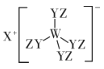
A.原子半径:W<X<Y<Z
B.简单离子的氧化性:W> X
C.X与Y、Y与Z均可形成具有漂白性的化合物
D.W与X的最高价氧化物的水化物可相互反应
【答案】A
【解析】
首先发现X是+1价的,则X为氢、锂或钠,但是W、X、Y三种简单离子的核外电子排布要相同,则X只能是钠,才能满足题意;W、Y、Z三者分别位于三个不同的周期,则必有一种为氢,根据题目给出的结构式,氢只能形成1个键,则Z是氢;结合Y的最外层电子数是W的最外层电子数的二倍,且二者简单离子的核外电子排布相同,则只能是氧和铝,根据结构不难发现W是铝,Y是氧,据此来解题即可。
A.根据分析,四种元素的半径大小为氢<氧<铝<钠,即Z<Y<W<X,A项错误;
B.钠单质的还原性强于铝,而![]() 的氧化性弱于
的氧化性弱于![]() ,B项正确;
,B项正确;
C.过氧化钠和过氧化氢均具有漂白性,C项正确;
D.W与X的最高价氧化物的水化物分别为![]() 和
和![]() ,二者可以相互反应,D项正确;
,二者可以相互反应,D项正确;
答案选A。

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目