题目内容
 下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.| a | b | ||||||||||||||||
| c | d | e | |||||||||||||||
| f | |||||||||||||||||
H2O
H2O
(用化学式填空),其原因是O元素的非金属性大于C元素,且水中存在氢键,导致水的熔点大于甲烷
O元素的非金属性大于C元素,且水中存在氢键,导致水的熔点大于甲烷
.(2)a和d可形成不同晶体,下列说法正确的是(NA是阿佛加德罗常数)
ad
ad
.A.元素a的单质可能是原子晶体或分子晶体
B.mg d元素形成的晶体中,含共价键数目为m NA/7
C.元素a与元素d形成的化合物40g,含NA个分子
D.元素d的最高价氧化物6g,含共价键物质的量为0.4mol
(3)c和e形成的化合物的中,每个阳离子周围距离最近且等距离的阳离子有
12
12
个,一个晶胞中的阴离子数目为4
4
个.晶体中阳离子和阴离子核间距为a cm,该化合物相对分子质量为M,NA为阿伏加德罗常数,则晶体密度为| M |
| 2a3NA |
| M |
| 2a3NA |
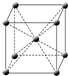
(4)f原子的外围电子排布式为
3d64s2
3d64s2
,其晶胞结构如图,f单质的晶体密度为ρg/cm3,f相对原子质量为M,阿伏伽德罗常数NA,则f的原子半径为
| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
分析:根据元素在周期表中的位置知,a、b、c、d、e、f分别是C、O、Na、Si、Cl、Fe元素,
(1)同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物的熔点越高,且水中存在氢键;
(2)C和Si可形成不同晶体,
A.碳元素的单质有金刚石、C60等,根据晶体中存在的微粒确定晶体类型;
B.d是Si元素,硅晶体中每个硅原子含有2个共价键;
C.元素a与元素d形成的化合物是碳化硅,碳化硅是原子晶体;
D.元素d的最高价氧化物是二氧化硅,二氧化硅晶体中每个硅原子含有4个硅氧键;
(3)Na和Cl形成的化合物的中,每个阳离子周围距离最近且等距离的阳离子有12个,一个晶胞中的阴离子数目为4个.晶体中阳离子和阴离子核间距为a cm,该化合物相对分子质量为M,NA为阿伏加德罗常数,根据ρ=
计算其密度;
(4)f是Fe元素,铁原子中3d和4s能级上的电子为其外围电子,根据构造原理书写其外围电子排布式;
利用均摊法计算该晶胞中铁原子个数,再结合密度公式进行计算.
(1)同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物的熔点越高,且水中存在氢键;
(2)C和Si可形成不同晶体,
A.碳元素的单质有金刚石、C60等,根据晶体中存在的微粒确定晶体类型;
B.d是Si元素,硅晶体中每个硅原子含有2个共价键;
C.元素a与元素d形成的化合物是碳化硅,碳化硅是原子晶体;
D.元素d的最高价氧化物是二氧化硅,二氧化硅晶体中每个硅原子含有4个硅氧键;
(3)Na和Cl形成的化合物的中,每个阳离子周围距离最近且等距离的阳离子有12个,一个晶胞中的阴离子数目为4个.晶体中阳离子和阴离子核间距为a cm,该化合物相对分子质量为M,NA为阿伏加德罗常数,根据ρ=
| m |
| V |
(4)f是Fe元素,铁原子中3d和4s能级上的电子为其外围电子,根据构造原理书写其外围电子排布式;
利用均摊法计算该晶胞中铁原子个数,再结合密度公式进行计算.
解答:解:根据元素在周期表中的位置知,a、b、c、d、e、f分别是C、O、Na、Si、Cl、Fe元素,
(1)同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物的熔点越高,且水中存在氢键,所以氢化物熔点较高的是H2O,
故答案为:H2O;O元素的非金属性大于C元素,且水中存在氢键,导致水的熔点大于甲烷;
(2)C和Si可形成不同晶体,
A.碳元素的单质有金刚石、C60等,金刚石为原子晶体,C60为分子晶体,所以元素a的单质可能是原子晶体或分子晶体,故正确;
B.硅晶体中每个硅原子含有2个共价键,所以mg Si元素形成的晶体中,含共价键数目=
×2×NA/mol=
,故错误;
C.元素a与元素d形成的化合物是碳化硅,碳化硅是原子晶体,其构成微粒是原子,所以不含分子,故错误;
D.元素d的最高价氧化物是二氧化硅,二氧化硅晶体中每个硅原子含有4个硅氧键,则元素d的最高价氧化物6g,其物质的量是0.1mol,则含共价键物质的量为0.4mol,故正确;
故选ad;
(3)Na和Cl形成的化合物的中,每个阳离子周围距离最近且等距离的阳离子个数=3×8×
=12,一个晶胞中的阴离子数目=8×
+6×
=4,该晶胞中阴阳离子个数都是4,晶体中阳离子和阴离子核间距为a cm,该化合物相对分子质量为M,NA为阿伏加德罗常数,ρ=
=
g/cm3 =
g/cm3,
故答案为:12;4;
;
(4)f是Fe元素,铁原子中3d和4s能级上的电子为其外围电子,根据构造原理知其外围电子排布式3d64s2;
该晶胞中铁原子个数=1+
×8=2,其密度ρ=
g/cm3,所以其V=
cm3,
设原子半径为x,设晶胞的棱长为y,y2+2y2=(4x)2
y=
x,其体积=(
x)3cm3=
cm3,x=
×
cm,
故答案为:3d64s2;
×
.
(1)同一周期元素中,元素的非金属性随着原子序数的增大而增强,元素的非金属性越强,其氢化物的熔点越高,且水中存在氢键,所以氢化物熔点较高的是H2O,
故答案为:H2O;O元素的非金属性大于C元素,且水中存在氢键,导致水的熔点大于甲烷;
(2)C和Si可形成不同晶体,
A.碳元素的单质有金刚石、C60等,金刚石为原子晶体,C60为分子晶体,所以元素a的单质可能是原子晶体或分子晶体,故正确;
B.硅晶体中每个硅原子含有2个共价键,所以mg Si元素形成的晶体中,含共价键数目=
| mg |
| 28g/mol |
| mNA |
| 14 |
C.元素a与元素d形成的化合物是碳化硅,碳化硅是原子晶体,其构成微粒是原子,所以不含分子,故错误;
D.元素d的最高价氧化物是二氧化硅,二氧化硅晶体中每个硅原子含有4个硅氧键,则元素d的最高价氧化物6g,其物质的量是0.1mol,则含共价键物质的量为0.4mol,故正确;
故选ad;
(3)Na和Cl形成的化合物的中,每个阳离子周围距离最近且等距离的阳离子个数=3×8×
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| m |
| V |
| ||
| (2a)3 |
| M |
| 2a3NA |
故答案为:12;4;
| M |
| 2a3NA |
(4)f是Fe元素,铁原子中3d和4s能级上的电子为其外围电子,根据构造原理知其外围电子排布式3d64s2;
该晶胞中铁原子个数=1+
| 1 |
| 8 |
| ||
| V |
| 2M |
| ρNA |
设原子半径为x,设晶胞的棱长为y,y2+2y2=(4x)2
y=
|
|
| 2M |
| ρNA |
| ||
| 4 |
| 3 |
| ||
故答案为:3d64s2;
| ||
| 4 |
| 3 |
| ||
点评:本题以元素周期律和元素周期表为载体考查了物质结构和性质,涉及晶胞的计算、晶体类型的判断、阿伏伽德罗常数的有关计算等知识点,难点是晶胞的计算,要求学生有丰富的空间想象能力及计算能力,难度较大.

练习册系列答案
相关题目



 NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是
NH4++OH-,试判断NH3溶于水后,形成的NH3?H2O的合理结构是 (4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是