��Ŀ����
����Ŀ���ҹ��Ŵ����������ڻ�ѧѧ��֪ʶ�϶����ֳ���һ��ˮƽ����ʶ�����С����ӵ��������м��أ������е�ɳ�ߣ����лƽ����д�ʯ�ߣ�����ͭ�𡣡�
��.����ɳ�ߵ�ɰҲ������ɰ�ǹŴ���������Ҫԭ�ϣ�Ҳ��ʵ���Ҵ���ˮ�������IJ������Ϊ��ɰ��Ҫ�ɷ���_____��(�ѧʽ)����ʯ�ߴ�ʯҲ������д����ʯ������������ӷ���ʽ��_____��
��.��ͭ���ߣ�����ͭ��Ҳ����
�������Dz�ͤͭ����dz��������γɿ�����·��ֵ�һ�����Ͱ����Ϳ�����ͭ����Cu��Ҫ��ͭ��������(��ҪΪCuFeS2)����ʽ���ڡ��Ի�ͭ��(��Ҫ�ɷ�ΪCuFeS2������������SiO2��)Ϊԭ�ϣ�����������ͭ��ͬʱ�õ�����Ʒ�̷�(FeSO47H2O)������Ҫ������ͼ��
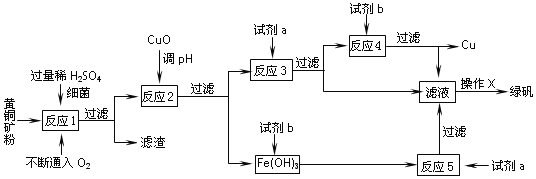
��֪���١���Ӧ1����4CuFeS2 +2H2SO4 +17O2 �T4CuSO4 +2Fe2(SO4)3 +2H2O
�ڲ���������������������ʽ��ʼ��������ȫ����ʱ��Һ��pH�����
������ | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
��ʼ����pH | 4.7 | 2.7 | 7.6 |
��ȫ����pH | 6.7 | 3.7 | 9.6 |
(1)����Ӧ1���У�ÿ����1 mol CuSO4ת�Ƶ�����Ϊ_____NA��
(2)���Լ�a����_____�����Լ�b����_____��
(3)����Ӧ2���м�CuO��pHΪ3.7��4.7��Ŀ����_____��
(4)������X��ӦΪ_____��_____�����ˡ�ϴ�ӣ����������������X������ζ����� FeSO47H2O�������ϴ��_____��
(5)��������жϡ���Ӧ5���ѽ�����ȫ��_____��
���𰸡�HgS Fe3O4+8H +��2Fe 3++Fe 2++4H2O 17 Fe�� ϡ���� ʹFe 3+�γ�Fe(OH)3��������ֹ����Cu(OH)2���� ����Ũ�� ��ȴ�ᾧ ��©���м�������ˮ����û���壬��ˮ��Ȼ���£��ظ�2��3�� ȡ������Ӧ����Һ���뼸�����軯����Һ����������������֤����Ӧ������ȫ
��������
��.ʵ��������Ƿ۴��������ˮ�������ɵIJ���ΪHgS����ʯ����Ҫ�ɷ�Ϊ�����������������ᷴӦ�����Ȼ������Ȼ�������ˮ��
��.��1�����ݷ���ʽ������Ԫ�ػ��ϼ۵ı仯ȷ��ת�Ƶ��ӵ���Ŀ��
��2�����ۿɽ�Fe3+��ԭΪFe2+��
��3����pH����Ϊ3.7��4.7���ɽ�Fe3+��ȫ������������Cu(OH)2������
��4������Һ�õ����壬�ɽ��м���Ũ������ȴ�ᾧ�Ȳ�����
��5����Ӧ5Ϊ�����������۵ķ�Ӧ�����ü��������ӵķ��������Ƿ�Ӧ�ꡣ
��.�������֪��ɰΪʵ���Ҵ���ˮ�������IJ��ӦΪHgS����ʯ����Ҫ�ɷ�Ϊ�����������������ᷴӦ�����Ȼ������Ȼ�������ˮ����Ӧ�����ӷ���ʽΪFe3O4+8H +��2Fe 3++Fe 2++4H2O��
��.��1���漰��ӦΪ4CuFeS2 +2H2SO4 +17O2 �T4CuSO4 +2Fe2(SO4)3 +2H2O����Ӧ��SԪ�ػ��ϼ��ɩ�2�����ߵ�+6�ۣ�FeԪ�ػ��ϼ���+2�����ߵ�+3�ۣ�����4molCuSO4��������17mol������ת��68mol���ӣ�������1molCuSO4��ת��17mol���ӣ��ʴ�Ϊ��17��
��2���Լ�a��Fe���Լ�b��ϡ���
��3����CuO��pHΪ3.7��4��Ŀ����ʹFe3+�γ�Fe(OH)3��������ֹ����Cu(OH)2������
��4������Һ�õ����壬�ɽ��м���Ũ������ȴ�ᾧ�Ȳ�����ϴ�Ӿ��壬����©���м�������ˮ����û���壬��ˮ��Ȼ���£��ظ�2��3�Σ�
��5����Ӧ5Ϊ�����������۵ķ�Ӧ�����ü��������ӵķ��������Ƿ�Ӧ�꣬������ȡ������Ӧ����Һ���뼸�����軯����Һ����������������֤����Ӧ������ȫ��

 �Ǽ�����������ϵ�д�
�Ǽ�����������ϵ�д� â���̸������Ծ�ϵ�д�
â���̸������Ծ�ϵ�д�