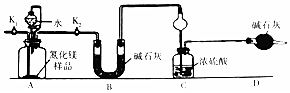
题目内容
20.在一定条件下,PbO2 与Cr3+反应,产物是Cr2O72- 与Pb2+,则与2molCr3+反应所需 PbO2 的物质的量为( )| A. | 3.0 mol | B. | 1.5mol | C. | 1.0mol | D. | 0.75mol |
分析 该反应中Pb元素化合价由+4价变为+2价、Cr元素化合价由+3价变为+6价,根据转移电子守恒计算PbO2的物质的量,以此解答该题.
解答 解:利用电子守恒,当1molCr3+被氧化为Cr2O72-(0.5mol)时,所失去的电子数为3mol,这些电子被PbO2得到,而1mol PbO2被还原只得到2mol电子,因此需要PbO2的物质的量为1.5mol,则与2molCr3+反应所需 PbO2 的物质的量为3.0mol.
故选A.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,注意根据化合价的变化结合氧化还原反应中氧化剂与还原剂得失电子数目相等进行计算.

练习册系列答案
相关题目
10.2A(g)+B(g)?3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是( )
| A. | v(A)=0.7 mol/(L.min) | B. | v(B)=0.3mol/(L.min) | ||
| C. | v(C)=0.9 mol/(L.min) | D. | v(D)=1.1mol/(L.min) |
11.X、Y、Z、W是原子序数依次增大的短周期主族元素,X、W在周期表的相对位置如图所示.X元素的最简单氢化物甲能使湿润的红色石蕊试纸变蓝,W元素是海水溶质中的一种主要的元素,X和Y同周期,Y与Z的最外层电子数之和与W的最外层电子数相等.请回答下列问题:
(1)W位于周期表中的位置第三周期第VIIA族.
(2)Z和W组成物质的电子式是 .
.
(3)Y、Z、W的常见离子的半径大小顺序是r(Cl-)>r(O2-)>r(Na+)(填离子符号)
(4)X与Y的第一电离能比较,第一电离能较大的是氮(填元素名称),其原因是N原子的2p轨道有3个电子,2p轨道半满.
(5)X的最简单氢化物甲与Y的单质在有催化剂存在时可以发生,写出该反应的化学方程式4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
| X | |||
| W |
(2)Z和W组成物质的电子式是
 .
.(3)Y、Z、W的常见离子的半径大小顺序是r(Cl-)>r(O2-)>r(Na+)(填离子符号)
(4)X与Y的第一电离能比较,第一电离能较大的是氮(填元素名称),其原因是N原子的2p轨道有3个电子,2p轨道半满.
(5)X的最简单氢化物甲与Y的单质在有催化剂存在时可以发生,写出该反应的化学方程式4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
15.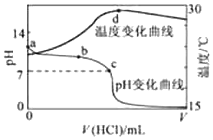 室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
 室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14mol/L | |
| B. | b点:c(NH4+)+c(NH3•H2O)>c(Cl-) | |
| C. | b点时加入的盐酸体积小于20.00mL,而c点时加入的盐酸体积大于20.00mL | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
5.铅蓄电池的总反应为:PbO2(s)+Pb(s)+2H2SO4(aq) $?_{充电}^{放电}$ 2PbSO4(s)+2H2O(l)关于铅蓄电池的说法正确的是( )
| A. | 在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-═PbSO4(s) | |
| B. | 在放电时,该电池的负极材料是铅板 | |
| C. | 在充电时,电池中硫酸的浓度不断变小 | |
| D. | 在充电时,阳极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
19.下列各个装置中能组成原电池的是( )
| A. |  | B. |  | C. |  | D. |  |