题目内容
(9分)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
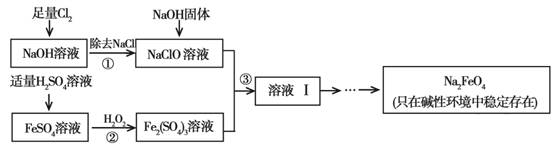
回答下列问题:
(1)经过步骤①后,加入NaOH固体的原因是____ ____。
(2)步骤②反应的离子方程式是_____ ___。
(3)从溶液Ⅰ中分离出Na2FeO4后,还有副产品Na2SO4 、NaCl,则步骤③中反应的离
子方程式为___ _____。
(4)将一定量的Na2FeO4投入到pH不同的污水中(污水中其余成分均相同),溶液中Na2FeO4浓度变化如下图曲线Ⅰ、Ⅱ所示,试推测曲线I比曲线II对应的污水pH_____(填“高”或“低”)。

(5)通过计算得知Na2FeO4的消毒效率(以单位质量得到的电子数表示)比氯气的_____(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是____ (答出两点即可)。
(1)Na2FeO4只在碱性环境中稳定存在,所以加入氢氧化钠可以调节溶液显碱性
(2)2Fe2++H2O2+2H+=2Fe3++2H2O (3)2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
(4)高 (5)低 既能消毒杀菌又能净水(或无毒或方便保存等)
【解析】(1)根据题意可知,Na2FeO4只有在碱性环境中稳定存在,所以加入氢氧化钠可以调节溶液显碱性,防止Na2FeO4反应。
(2)双氧水具有氧化性,能氧化亚铁离子,方程式为2Fe2++H2O2+2H+=2Fe3++2H2O。
(3)根据反应物和生成物可知,还原产物是氯化钠,所以方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O。
(4)根据图像可知,曲线I中Na2FeO4浓度高。又因为Na2FeO4只有在碱性条件下才能稳定存在,所以曲线I的pH高。
(5)Na2FeO4的还原产物是铁离子,得到3个电子,因此每得到1mol电子消耗的质量是55.33g,而35.5g氯气就得到1mol电子,所以Na2FeO4的消毒效率比氯气的低;由于Na2FeO4在杀菌消毒的同时,生成的铁离子能水解生成氢氧化铁胶体,吸附水中的悬浮物,还起净水剂的作用。

| ||
| A、反应中Na2O2是氧化剂 |
| B、Fe2O3可以通过铁丝在氧气中燃烧制得 |
| C、生成1 mol Na2FeO4,有6 mol电子转移 |
| D、在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |


 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g?mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.