题目内容
【题目】饮用水中含有砷会导致砷中毒,金属冶炼过程产生的含砷有毒废弃物需处理与检测。冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
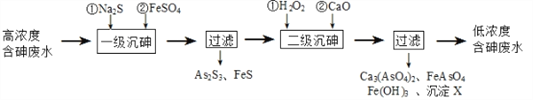
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33-(aq);
2AsS33-(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)砷是第四周期VA族元素,则砷的原子序数为________;AsH3的电子式为____________;
(2)根据元素周期律,下列说法正确的是_________。
a.酸性:H2SO4>H3PO4>H3AsO4 b.原子半径:S>P>As
c.非金属性:S>P>As
(3)砷酸的第一步电离方程式为________________。
(4)沉淀X为_________________(填化学式)。
(5)“一级沉砷”中FeSO4的作用是____________________________________________;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_____________________________。
(6)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水。FeS2被O2氧化的离子方程式为______________________
【答案】 33 ![]() ac H3AsO4
ac H3AsO4![]() H++H2AsO4- CaSO4 沉淀过量的S2-,使As2O3(a)+3S2-(aq)
H++H2AsO4- CaSO4 沉淀过量的S2-,使As2O3(a)+3S2-(aq)![]() 2AsS32-(aq)平衡左移,提高沉砷效果 H3AsO3+H2O2=H3AsO4+H2O 4FeS2+15O2+14H2O
2AsS32-(aq)平衡左移,提高沉砷效果 H3AsO3+H2O2=H3AsO4+H2O 4FeS2+15O2+14H2O![]() 4Fe(OH)3+8SO42+16H+
4Fe(OH)3+8SO42+16H+
【解析】(1)砷是第四周期VA族元素,则砷的原子序数为33,AsH3为共价化合物,AsH3的电子式为![]() ;正确答案:33;
;正确答案:33; ![]() 。
。
(2)非金属性越强,最高价氧化物的水化物的酸性就越强,非金属性S>P>As,所以酸性:H2SO4>H3PO4>H3AsO4,a正确;同一周期从左到右,原子半径逐渐减小;同一主族,从上到下,原子半径逐渐增大;因此原子半径:As>P>S;b错误;非金属元素的原子半径越小,元素的非金属性就越强,因此非金属性:S>P>As,c正确;正确答案:ac。
(3)H3AsO4为三元弱酸,能发生三步电离,第一步电离方程式为H3AsO4![]() H++H2AsO4- ;正确答案:H3AsO4
H++H2AsO4- ;正确答案:H3AsO4![]() H++H2AsO4- 。
H++H2AsO4- 。
(4)未完全沉淀的![]() 可被
可被![]() 氧化为
氧化为![]() ,
,![]() 溶于水后生成
溶于水后生成![]() ,
,![]() 与
与![]() 反应生成
反应生成![]() 沉淀;正确答案:CaSO4。
沉淀;正确答案:CaSO4。
(5)“一级沉砷”中FeSO4的作用是沉淀过量的S2-,使As2O3(a)+3S2-(aq)![]() 2AsS32-(aq)平衡左移,提高沉砷效果; “二级沉砷”中H2O2与含砷物质反应的化学方程式为H3AsO3+H2O2=H3AsO4+H2O ;正确答案:沉淀过量的S2-,使As2O3(a)+3S2-(aq)
2AsS32-(aq)平衡左移,提高沉砷效果; “二级沉砷”中H2O2与含砷物质反应的化学方程式为H3AsO3+H2O2=H3AsO4+H2O ;正确答案:沉淀过量的S2-,使As2O3(a)+3S2-(aq)![]() 2AsS32-(aq)平衡左移,提高沉砷效果; H3AsO3+H2O2=H3AsO4+H2O。
2AsS32-(aq)平衡左移,提高沉砷效果; H3AsO3+H2O2=H3AsO4+H2O。
(6)黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-; FeS2被O2氧化的离子方程式为4FeS2+15O2+14H2O![]() 4Fe(OH)3+8SO42+16H+;正确答案:4FeS2+15O2+14H2O
4Fe(OH)3+8SO42+16H+;正确答案:4FeS2+15O2+14H2O![]() 4Fe(OH)3+8SO42+16H+。
4Fe(OH)3+8SO42+16H+。