题目内容
20.在下面的装置中,A是Cl2发生装置,C、D为气体净化装置,C中装有饱和NaCl溶液,D中装有浓H2SO4;E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.
试回答:
(1)C、D两个装置的作用是:
C除氯气中的氯化氢气体,
D除水蒸气.
(2)F中的生成物是FeCl3(填化学式).
(3)写出在A、G中发生反应的化学方程式为:
A:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
G:Cl2+2NaOH=NaCl+NaClO+H2O.
分析 (1)浓盐酸易挥发,制取的氯气中含有水蒸气和氯化氢,通过C、D装置分别除去氯化氢和水蒸气;
(2)干燥的氯气和铁反应生成棕色烟氯化铁固体颗粒;
(3)A中发生的反应:二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水;
G中发生的反应为:氯气与氢氧化钠反应生成氯化钠和次氯酸钠和水.
解答 解:(1)浓盐酸易挥发,制取的氯气中含有水蒸气和氯化氢,C是饱和食盐水除去氯化氢气体和D是浓硫酸干燥,
故答案为:除氯气中的氯化氢气体;除水蒸气;
(2)干燥的氯气和铁反应生成氯化铁固体颗粒,方程式:2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3;
故答案为:FeCl3;
(3)A中发生的反应:二氧化锰与浓盐酸在加热条件下反应生成氯气、氯化锰和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
G中发生的反应为:氯气与氢氧化钠反应生成氯化钠和次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O.
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;Cl2+2NaOH=NaCl+NaClO+H2O.
点评 本题考查了实验室制备氯气的实验过程和除杂分析判断,尾气处理方法,主要是反应离子方程式的书写和氯气性质的分析判断,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列实验操作或记录正确的是( )
| A. | 常温常压下测得1 mol N2的质量为28 g | |
| B. | 用量筒测得排水法收集到的氢气体积为50.28 mL | |
| C. | 用两只250 mL的容量瓶配制0.1 mol/L 500 mL的NaOH溶液 | |
| D. | 用托盘天平称得2.5 g胆矾,受热充分失水后,固体质量减轻0.9 g |
15.2.0LAlCl3溶液中含Cl-9.03×1023个,则溶液物质的量浓度是( )
| A. | 0.1mol/L | B. | 0.25mol/L | C. | 1mol/L | D. | 1.5mol/L |
12.下列说法正确的有( )
| A. | 原电池是将电能转变为化学能的装置 | |
| B. | 原电池工作时,阳离子向负极方向移动 | |
| C. | 反应Cu+2H+=Cu2++H2↑可设计成原电池装置 | |
| D. | 锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率 |
9.某工厂使用石油热裂解的副产物CH4来制取H2,其生产流程如图1所示:

(1)第II步反应为CO(g)+H2O(g)?H2(g)+CO2(g)△H<0,其平衡常数随温度的变化如下:
在830℃下,若开始时向恒容密闭容器中充入CO与H2O均为1mo1,则达到平衡后CO的转化率为50%.
(2)第II步反应CO(g)+H2O(g)?H2(g)+CO2(g),在830℃,向恒容反应器中加入下列物质发生上述反应,其中反应开始时,向正反应方向进行的有B(填实验编号).
(3)在一个不传热的恒容容器中,判断第II步反应达平衡的标志是③④(填序号).
①体系的压强不再变化 ②混合气体的平均相对分子质量不再变化
③体系中各物质的浓度不再改变 ④体系的温度不再变化
⑤混合气体的密度不再变化
(4)图2表示此流程的第II步反应在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则图中t2时刻发生改变的条件是降低温度或增加水蒸汽的量或减少氢气的量(只写2种).
(5)若400℃时,第Ⅱ步反应生成l molH2放出的热量为 33.2kJ,第Ⅰ步反应的热化学方程式为 CH4(g)+H2O(g)═CO(g)+3H2(g)△H=-103.3kJ•mol-1.
则400℃时,CH4和水蒸气反应生成CO2和H2的热化学方程式为CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=-136.5kJ•mol-1.

(1)第II步反应为CO(g)+H2O(g)?H2(g)+CO2(g)△H<0,其平衡常数随温度的变化如下:
| 温度T/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
(2)第II步反应CO(g)+H2O(g)?H2(g)+CO2(g),在830℃,向恒容反应器中加入下列物质发生上述反应,其中反应开始时,向正反应方向进行的有B(填实验编号).
| 实验编号 | n(CO)/mol | n(H2O)/mol | n(H2)/mol | n(CO2)/mol |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 0.5 | 2 | 1 | 1 |
①体系的压强不再变化 ②混合气体的平均相对分子质量不再变化
③体系中各物质的浓度不再改变 ④体系的温度不再变化
⑤混合气体的密度不再变化
(4)图2表示此流程的第II步反应在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则图中t2时刻发生改变的条件是降低温度或增加水蒸汽的量或减少氢气的量(只写2种).
(5)若400℃时,第Ⅱ步反应生成l molH2放出的热量为 33.2kJ,第Ⅰ步反应的热化学方程式为 CH4(g)+H2O(g)═CO(g)+3H2(g)△H=-103.3kJ•mol-1.
则400℃时,CH4和水蒸气反应生成CO2和H2的热化学方程式为CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=-136.5kJ•mol-1.

 2CH3CHO+2H2O
2CH3CHO+2H2O 
 (其中一种)
(其中一种)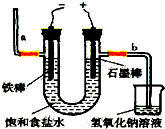 氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答:
氯气是一种重要的化工原料,自来水消毒、农药的生产、药物的合成等都需要用到氯气.工业上通常采用电解法制氯气:观察如图,回答: