题目内容
【题目】下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题: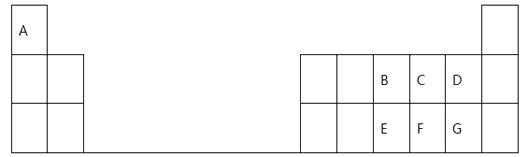
(1)画出C的原子结构示意图:。
(2)E在元素周期表中的位置是。
(3)B、C、D、F四种元素所形成的气态氢化物最稳定的是(填化学式)。
(4)E、F、G元素的最高价氧化物对应水化物的酸性最强的是(填化学式)。
(5)A、B、G三元素形成的化合物的电子式是 , 其中所含的化学键有哪些类型。
(6)B的最高价氧化物的水化物的稀溶液与金属铜反应的离子方程式为。
【答案】
(1)
(2)第三周期第VA族
(3)HF
(4)HClO4
(5) ;离子键和共价键
;离子键和共价键
(6)3Cu+8H++2NO3- = 3Cu2++2NO↑+4H2O
【解析】(1)C为O元素,原子序数为8,原子核外有两个电子层,最外层电子数为6,则原子结构示意图为  ;
;
(2)E为P元素,原子序数为15,核外有3个电子层,最外层电子数为5,则位于周期表第三周期ⅤA族;
(3)B、C、D、F四种元素中非金属性最强的是F元素,对应的氢化物的稳定性最强,故HF最稳定;
(4)同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物的水化物的酸性逐渐增强;
(5)A、B、G三元素形成的化合物为NH4Cl,为离子化合物,含有离子键和共价键,电子式为  ;
;
(6)稀硝酸溶解Cu生成硝酸铜和NO,发生反应的离子方程式为3Cu+8H++2NO3- = 3Cu2++2NO↑+4H2O。
故答案为:(1) ;(2)第三周期第VA族;(3)HF;(4)HClO4;(5)
;(2)第三周期第VA族;(3)HF;(4)HClO4;(5) ;离子键和共价键;(6)3Cu+8H++2NO3- = 3Cu2++2NO↑+4H2O
;离子键和共价键;(6)3Cu+8H++2NO3- = 3Cu2++2NO↑+4H2O
本题是对元素周期表结构、元素周期律的综合考查。解答此题的关键在于熟练掌握元素周期表的结构,熟记元素周期表的性质递变规律。对于第(4)问电子式的书写,应注意NH4+、Cl-应写出其最外层电子结构。

【题目】氮、碳都是重要的非金属元素,含氮、碳元素的物质在工业生产中有重要的应用.
(1)请写出工业上由NH3制取NO的化学方程式 .
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)FeO(s)+CO(g),已知该反应的平衡常数K与温度T的关系如图所示.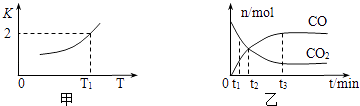
①该反应的逆反应是(填“吸热”或“放热”)反应.
②T℃、P pa压强下,在体积为VL的容器中进行反应,下列能说明反应达到平衡状态的是 .
A、混合气体的平均相对分子质量不再变化;
B、容器内压强不再变化;
C、v正(CO2)=v逆(FeO)
③T1温度下,向体积为V L的密闭容器中加入足量铁粉并充入一定量的CO2 , 反应过程中CO和CO2物质的量与时间的关系如图乙所示.则CO2的平衡转化率为 , 平衡时混合气体的密度与起始时气体的密度之比为 .
(3)在恒温条件下,起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2+3H22NH3 , 有关数据及平衡状态特定见表.
容器 | 起始投入 | 达平衡时 | |||
甲 | 2mol N2 | 3mol H2 | 0mol NH3 | 1.5mol NH3 | 同种物质的体积分数相同 |
乙 | a mol N2 | b mol H2 | 0mol NH3 | 1.2mol NH3 | |
起始时乙容器中的压强是甲容器的倍.
(4)一定条件下,2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量.生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的 ![]() 倍.请写出该反应的热化学方程式 .
倍.请写出该反应的热化学方程式 .
