题目内容
12.下列离子方程式不正确的是( )| A. | 向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| B. | 等物质的量浓度的FeI2溶液与溴水等体积混合:2Fe2++2I-+2Br2═2Fe3++I2+4Br- | |
| C. | 用惰性电极电解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 硫氢化钠水解:HS-+H2O?H2S+OH- |
分析 A.滴加Ba(OH)2溶液恰好至中性,生成硫酸钡、硫酸钠和水;
B.等物质的量浓度的FeI2溶液与溴水等体积混合,由电子守恒及还原性强弱可知,只有碘离子被氧化;
C.电解生成Cu、氧气和硫酸;
D.水解为可逆反应,生成氢硫酸和氢氧根离子.
解答 解:A.向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至中性的离子反应为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故A正确;
B.等物质的量浓度的FeI2溶液与溴水等体积混合的离子反应为2I-+Br2═I2+2Br-,故B错误;
C.用惰性电极电解CuSO4溶液的离子反应为2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,故C正确;
D.硫氢化钠水解离子反应为HS-+H2O?H2S+OH-,故D正确;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,注重离子反应的综合训练,题目难度不大.

练习册系列答案
相关题目
4.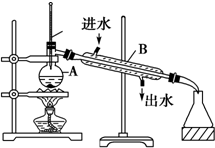 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题
(1)图中有两处明显的错误是
①温度计水银球应位于蒸馏烧瓶的支管处;
②冷凝管中冷凝水应低进高出.
(2)阅读分析表格信息,回答问题:
将乙二醇和丙三醇相互分离的最佳方法是A(填序号).
A.蒸馏法 B.萃取法 C.过滤法 D.分液法.
 如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题
如图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题(1)图中有两处明显的错误是
①温度计水银球应位于蒸馏烧瓶的支管处;
②冷凝管中冷凝水应低进高出.
| 物质 | 熔点/℃ | 沸点/℃ | 密度 /g•cm-3 | 溶解性 |
| 乙二醇 (C2H6O2) | -11.5 | 198 | 1.11 | 易溶于水 和乙醇 |
| 丙三醇 (C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精 以任意比互溶 |
将乙二醇和丙三醇相互分离的最佳方法是A(填序号).
A.蒸馏法 B.萃取法 C.过滤法 D.分液法.
5.某反应:A→C 由两步反应 A→B→C 完成,B 为中间产物,该反应能量曲线如图所示(E 表示能量).下列有关叙述正确的是( )

| A. | 两步反应均为吸热反应 | |
| B. | 加入催化剂不会改变 A→C 的反应热 | |
| C. | 三种化合物中 C 最稳定 | |
| D. | 整个反应中△E=E4-E1-E2-E3 |
2.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 10L0.1mol•L-1的氨水中含有NA个NH4+ | |
| B. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| C. | 标准状况下,22.4L四氯化碳中含有NA个CCl4分子 | |
| D. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
7.基态原子的核外电子排布的原则不包括( )
| A. | 能量最低原理 | B. | 能量守恒原理 | C. | 泡利原理 | D. | 洪特规则 |
1.化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A. | 二氧化硫和二氧化氮是引起酸雨的主要气体 | |
| B. | 金属钠、电石着火时,直接用高压水枪喷水扑灭 | |
| C. | 玛瑙饰品的主要成分与建筑材料砂子相同 | |
| D. | 家庭中洁厕灵与“84消毒液”不能同时使用 |
2.下列离子反应方程式,书写正确的是( )
| A. | 石灰石中加入稀盐酸:CO32-+2H+═H2O+CO2↑ | |
| B. | 稀硫酸中加入铁粉:Fe+2H+═Fe2++H2↑ | |
| C. | 硝酸银溶液中加入铜粉:Ag++Cu═Cu2++Ag | |
| D. | Ba(OH)2溶液中加入硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
 <
< (填“>”“<”或“=”)
(填“>”“<”或“=”)