题目内容
4.若NA表示阿伏伽德罗常数则下列说法正确的是( )| A. | 标准状况下,22.4LHF分子中所含的原子数约为2NA | |
| B. | 1mol冰中,平均所含氢键的数目为NA | |
| C. | 在氧化还原反应中,1molH2O2转移的电子数为2NA | |
| D. | 13gCnHn分子中最多含C-C数为1.5NA |
分析 A、标准状况下,HF的状态不是气体,不能使用标况下的气体摩尔体积计算其物质的量;
B、1mol冰中存在2mol氢键;
C、1mol过氧化氢只做氧化剂电子转移2NA,若自身氧化还原反应,电子转移1mol;
D、13gCnHn分子物质的量$\frac{13g}{13ng/mol}$=$\frac{1}{n}$mol,最多含C-C数$\frac{1}{n}$×$\frac{3n}{2}$=1.5mol.
解答 解:A、标况下,氟化氢不是气体,不能使用标况下的气体摩尔体积计算22.4L氟化氢的物质的量,故A错误;
B、冰中水分子的O原子以类似于金刚石中C原子的四面体空间网状结构排列,每2个O原子间都有一个H原子,更靠近H原子的O原子与它形成共价键,另一个与它形成氢键,即每个H原子都形成一个氢键,所以1mol冰中存在2mol氢键,故B错误;
C、1mol过氧化氢只做氧化剂电子转移2NA,若自身氧化还原反应,电子转移1mol,在氧化还原反应中,1molH2O2转移的电子数不一定为2NA,故C错误;
D、13gCnHn分子物质的量$\frac{13g}{13ng/mol}$=$\frac{1}{n}$mol,最多含C-C数$\frac{1}{n}$×$\frac{3n}{2}$=1.5mol=1.5NA,故D正确;
故选D.
点评 本题考查了阿伏加德罗常数的分析应用,主要是气体摩尔体积条件应用,物质结构分析,化学键形成数的计算应用,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
14.某同学用某种粗盐进行提纯实验,步骤见下图.请回答:
(1)步骤②的操作名称是过滤.
(2)步骤③发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.
步骤④加热蒸发时要用玻璃棒不断搅拌,目的是防止局部温度过高而溅出液体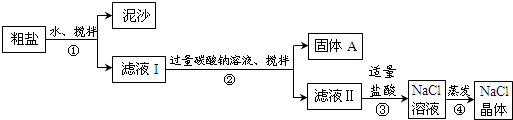
(3)猜想和验证:
(1)步骤②的操作名称是过滤.
(2)步骤③发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.
步骤④加热蒸发时要用玻璃棒不断搅拌,目的是防止局部温度过高而溅出液体

(3)猜想和验证:
| 猜想 | 验证的方法 | 现象 | 结论 |
| 猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | ①有气泡冒出且澄清石灰水变浑浊 | 猜想Ⅰ成立 |
| 猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入②稀盐酸或稀硝酸,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | ③猜想II不成立 |
| 猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水, ④加入硝酸酸化的硝酸钡溶液 | ⑤产生不溶于稀硝酸的白色沉淀 | 猜想Ⅲ成立 |
15.下列各组物质发生反应后,只可能生成一种气体产物的是( )
| A. | 木炭在氧气中燃烧 | B. | 铁粉与高温水蒸气反应 | ||
| C. | 碳酸氢铵受热分解 | D. | Na2O2加入氯化铵溶液中 |
19.下列化学用语正确的是( )
| A. | 氯化氢的电子式为 H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{CI}}{••}$${\;}_{•}^{•}$]- | |
| B. | 乙炔的结构简式(删:可以)写成 CHCH | |
| C. | 镁的原子结构示意图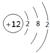 | |
| D. | 碳酸氢钠溶于水电离方程式:NaHCO3═Na++H++CO32- |
7. 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
 合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义.对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的小 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,773K下反应至t1时刻,n(H2)比图中d点的值大 |
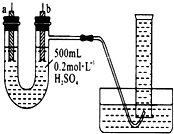 给你提供纯锌、纯铜片、500 mL 0.2 mol/L的H2SO4溶液、导线、1 000 mL量筒.试用如图装置来测定锌和稀硫酸反应时,在某段时间内通过导线的电子的物质的量.
给你提供纯锌、纯铜片、500 mL 0.2 mol/L的H2SO4溶液、导线、1 000 mL量筒.试用如图装置来测定锌和稀硫酸反应时,在某段时间内通过导线的电子的物质的量.