题目内容
在2L Al2(SO4)3和(NH4)2SO4的混合溶液中加入2mol BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到1mol NH3,则原溶液中Al3+的浓度为
- A.2mol?L-1
- B.0.25mol?L-1
- C.1mol?L-1
- D.0.5mol?L-1
D
分析:根据SO42-+Ba2+═BaSO4↓计算溶液中的SO42-离子的物质的量,根据NH4++OH- NH3↑+H2O计算NH4+的物质的量,再根据c=
NH3↑+H2O计算NH4+的物质的量,再根据c= 计算SO42-离子、NH4+离子浓度,再利用电荷守恒有3n(Al3+)+c(NH4+)=2c(SO42-),据此计算原溶液中的Al3+浓度.
计算SO42-离子、NH4+离子浓度,再利用电荷守恒有3n(Al3+)+c(NH4+)=2c(SO42-),据此计算原溶液中的Al3+浓度.
解答:由混合溶液中加入2molBaCl2,恰好使溶液中的SO42-离子完全沉淀,则:
SO42-+Ba2+═BaSO4↓
2mol 2mol
c(SO42-)=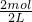 =1mol/L,
=1mol/L,
由加入足量强碱并加热可得到1molNH3,则:
NH4++OH- NH3↑+H2O
NH3↑+H2O
1mol 1mol
c(NH4+)=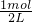 =0.5mol/L,
=0.5mol/L,
又溶液不显电性,设原溶液中的Al3+浓度为x,由电荷守恒可知,
x×3+0.5mol/L×1=1mol/L×2,
解得x=0.5mol/L,
故选D.
点评:本题考查混合物的有关计算、根据离子方程的计算、物质的量浓度的计算等,清楚发生的离子反应及溶液不显电性是解答本题的关键,熟悉物质的量浓度的计算公式.
分析:根据SO42-+Ba2+═BaSO4↓计算溶液中的SO42-离子的物质的量,根据NH4++OH-
 NH3↑+H2O计算NH4+的物质的量,再根据c=
NH3↑+H2O计算NH4+的物质的量,再根据c= 计算SO42-离子、NH4+离子浓度,再利用电荷守恒有3n(Al3+)+c(NH4+)=2c(SO42-),据此计算原溶液中的Al3+浓度.
计算SO42-离子、NH4+离子浓度,再利用电荷守恒有3n(Al3+)+c(NH4+)=2c(SO42-),据此计算原溶液中的Al3+浓度.解答:由混合溶液中加入2molBaCl2,恰好使溶液中的SO42-离子完全沉淀,则:
SO42-+Ba2+═BaSO4↓
2mol 2mol
c(SO42-)=
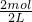 =1mol/L,
=1mol/L,由加入足量强碱并加热可得到1molNH3,则:
NH4++OH-
 NH3↑+H2O
NH3↑+H2O1mol 1mol
c(NH4+)=
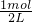 =0.5mol/L,
=0.5mol/L,又溶液不显电性,设原溶液中的Al3+浓度为x,由电荷守恒可知,
x×3+0.5mol/L×1=1mol/L×2,
解得x=0.5mol/L,
故选D.
点评:本题考查混合物的有关计算、根据离子方程的计算、物质的量浓度的计算等,清楚发生的离子反应及溶液不显电性是解答本题的关键,熟悉物质的量浓度的计算公式.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目