题目内容
化学反应N2+3H2═2NH3 的能量变化如图所示,以下叙述正确的是( )
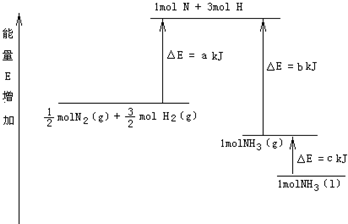

分析:反应热△H=生成物的总能量-反应物的总能量,△H<0表示放热,△H>0表示吸热,并结合盖斯定律判断.
解答:解:A、1molN和3molH的总能量比
molN2和
molH2总能量高,所以
molN2和
molH2转变为1molN和3molH吸收能量,由图可知吸收能量aKJ,故A错误;
B、1molN和3molH总能量比1molNH3(g)的总能量高,所以1molN和3molH结合成1molNH3(g)时放出热量,由图可知放出热量bKJ,故B正确;
C、1molNH3(l)的能量比1molNH3(g)的能量低,所以1molNH3(l)转变为1molNH3(g)时吸收热量,由图可知吸收热量cKJ,故C错误;
D、由图可知
molN2和
molH2的总能量比1molNH3(l)的能量高,所以
molN2和
molH2反应生成1molNH3(l)放热反应,故D错误.
故选:B.
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
B、1molN和3molH总能量比1molNH3(g)的总能量高,所以1molN和3molH结合成1molNH3(g)时放出热量,由图可知放出热量bKJ,故B正确;
C、1molNH3(l)的能量比1molNH3(g)的能量低,所以1molNH3(l)转变为1molNH3(g)时吸收热量,由图可知吸收热量cKJ,故C错误;
D、由图可知
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
故选:B.
点评:本题考查学生根据物质的能量理解反应热,难度不大,反应热△H=生成物的总能量-反应物的总能量,△H<0表示放热,△H>0表示吸热.

练习册系列答案
相关题目
 化学反应N2+3H2→2NH3的能量变化如图所示,该反应的热化学方程式是( )
化学反应N2+3H2→2NH3的能量变化如图所示,该反应的热化学方程式是( )| A、N2(g)+H2(g)→NH3(1)-46 kJ | B、N2(g)+H2(g)→NH3(g)-454 kJ | C、N2(g)+3 H2(g)→2 NH3(g)+92 kJ | D、N2(g)+3 H2(g)→2 NH3(1)+431.3 kJ |
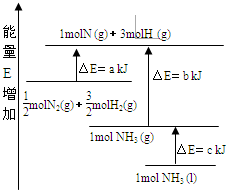 化学反应N2+3H2?2NH3的能量变化如图所示,E是正值,该反应的热化学方程式是( )
化学反应N2+3H2?2NH3的能量变化如图所示,E是正值,该反应的热化学方程式是( )| A、N2(g)+3H2(g)?2NH3(l);△H=2(a-b-c)kJ?mol-1 | ||||
| B、N2(g)+3H2(g)?2NH3(g);△H=2(b-a)kJ?mol-1 | ||||
C、
| ||||
D、
|
 (2008?重庆)化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )
(2008?重庆)化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )