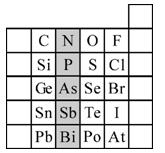
题目内容
根据元素F、S、Cl在周期表中的位置,关于F、S、Cl的说法正确的是( )A.非金属性:F>S>Cl
B.原子半径:Cl>S>F
C.稳定性:HF>HCl>H2S
D.酸性:HClO4>H2SO4
【答案】分析:A.同周期非金属性从左向右增强,同主族从上到下非金属性减弱;
B.同周期原子半径从左向右减小,同主族从上到下原子半径增大;
C.非金属性越强,气态氢化物越稳定;
D.非金属性越强,最高价氧化物的水化物的酸性越强.
解答:解:A.F、Cl同主族,S、Cl同周期,则非金属性F>Cl>S,故A错误;
B.F、Cl同主族,S、Cl同周期,则原子半径为S>Cl>F,故B错误;
C.非金属性F>Cl>S,则稳定性为HF>HCl>H2S,故C正确;
D.非金属性Cl>S,则最高价氧化物的水化物的酸性为HClO4>H2SO4,故D正确;
故选CD.
点评:本题考查位置、结构、性质的关系,熟悉位置及元素周期律即可解答,题目难度不大.
B.同周期原子半径从左向右减小,同主族从上到下原子半径增大;
C.非金属性越强,气态氢化物越稳定;
D.非金属性越强,最高价氧化物的水化物的酸性越强.
解答:解:A.F、Cl同主族,S、Cl同周期,则非金属性F>Cl>S,故A错误;
B.F、Cl同主族,S、Cl同周期,则原子半径为S>Cl>F,故B错误;
C.非金属性F>Cl>S,则稳定性为HF>HCl>H2S,故C正确;
D.非金属性Cl>S,则最高价氧化物的水化物的酸性为HClO4>H2SO4,故D正确;
故选CD.
点评:本题考查位置、结构、性质的关系,熟悉位置及元素周期律即可解答,题目难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目